
| A. | 将Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| C. | 用锌粉还原AgCl浊液获得银:2AgCl+Zn═2Ag+Zn2++2Cl- | |
| D. | 向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液:Fe2++2OH-═Fe(OH)2↓ |
分析 A.三价铁具有氧化性能氧化碘离子;
B.氢氧化钠过量反应生成碳酸钙、碳酸钠和水;
C.二者反应生成氯化锌和银;
D.氢氧化钠过量,氨根离子、二价铁离子都发生反应;
解答 解;A.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2,故A错误;
B.向Ca(HCO3)2溶液中加入过量NaOH溶液,离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故B错误;
C.用锌粉还原AgCl浊液获得银,离子方程式:2AgCl+Zn═2Ag+Zn2++2Cl-,故C正确;
D.向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液,离子方程式:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH4+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写原则和注意问题,侧重考查氧化还原反应、复分解反应的离子方程式书写,解题时注意不要漏写反应的离子,反应应遵循客观事实.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
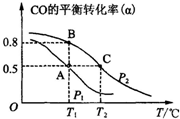 利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
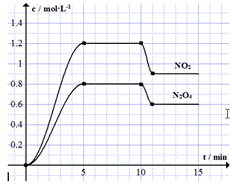 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、-4 |
| 元素 | D | M | G | E |
| 性质 结构 信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 氢化物常温下呈液态,M的双原子阴离子有18个电子 | 原子核外的M层比L层少2个电子. | +3价阳离子的核外电子排布与氖原子相同. |
 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com