
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A. 分散质粒子直径与分散系种类:![]()
B. NaOH溶液与CO2反应后溶液中的钠盐: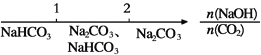
C. AlCl3溶液中滴加NaOH溶液后铝的存在形式:![]()
D. Na与O2反应的产物:![]()
【答案】D
【解析】A项正确,根据分散质粒子直径大小,将常见混合物分为溶液、胶体和浊液,分散质粒子直径1小于10-9m的属于溶液,大于10-7m的属于浊液,介于10-9—10-7m之间的属于胶体;B项正确,CO2与碱反应时产物与二者的相对量有关,如:①CO2足量时:CO2+NaOH=NaHCO3②CO2不足时:CO2+2NaOH=Na2CO3+H2O,![]() <1时,只发生反应①,生成NaHCO3,
<1时,只发生反应①,生成NaHCO3,![]() >2时,只发生反应②,生成Na2CO3,1<
>2时,只发生反应②,生成Na2CO3,1<![]() <2时,既有NaHCO3又有Na2CO3;C项正确,可能发生反应为:①Al3++3OH-(少量) =Al(OH)3↓②Al3++4OH-(足量) =AlO2-+H2O,
<2时,既有NaHCO3又有Na2CO3;C项正确,可能发生反应为:①Al3++3OH-(少量) =Al(OH)3↓②Al3++4OH-(足量) =AlO2-+H2O,![]() <3时,只发生①生成Al(OH)3↓,剩余Al3+,
<3时,只发生①生成Al(OH)3↓,剩余Al3+,![]() >4时,只发生反应②生成AlO2-,剩余OH-,3<
>4时,只发生反应②生成AlO2-,剩余OH-,3<![]() <4时,既有Al(OH)3又有AlO2-;D项错误,Na与氧气反应产物与反应条件有关,一般常温生成Na2O,加热生成Na2O2。综上所述,答案选D。
<4时,既有Al(OH)3又有AlO2-;D项错误,Na与氧气反应产物与反应条件有关,一般常温生成Na2O,加热生成Na2O2。综上所述,答案选D。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是

A. pH=4时,c(HAˉ)<c(A2-)
B. c(H2A)+c(HAˉ)+c(A2-)是定值
C. 该酸的电离常数Ka1=10-1.3
D. 常温下,NaHA的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置(夹持装置略去),在实验室模拟候氏制碱工艺中NaHCO3的制备。下列说法不正确的是

A. 应先向③中通入足量NH3,再通入足量CO2
B. 装置①也可用于制H2
C. ③中反应的离子方程式为NH3+CO2+H2O=NH4++HCO3-
D. ③、⑤中应分别盛放饱和食盐水和浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O) (相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式______________________________________。
(2)步骤③“酸溶”,最适合选用的酸为______________,为提高酸溶速率,可采取的措施是__________(任意写出一条)。
(3)若步骤④沉铅”后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)从原子利用率的角度分析该流程的优点为_______________________。
(5)步骤⑥“合成”三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__ % (结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( )


A. 图1表示合成氨(放热反应),温度T1和T2对应的平衡常数为K1、K2,则T1<T2,K1>K2
B. 图2所示,反应:X(g)+2Y(g)![]() 3Z(g),b的温度比a高
3Z(g),b的温度比a高
C. 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D. 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t ℃时,Ag2CrO4的Ksp为1×10-8
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等
D. t ℃时,将0.1 mol·L-1 AgNO3滴入20 mL 0.1 mol·L-1 KCl和0.1 mol·L-1 K2CrO4的溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天技术测得三氧化二碳(C2O3)是金星大气层的成份之一,下列关于C2O3的说法中错误的是
A.C2O3与CO2都是碳的氧化物B.C2O3与CO2都是碳酸的酸酐
C.C2O3与CO都具有还原性D.C2O3与C的燃烧产物都是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇。已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)=2H2O(l) △H=- 283.0kJ/mol;
②2CH3OH (1)+3O2=2CO2(g)+4H2O(1) △H=- 726.0kJ/mol。
(1)写出二氧化碳与氢气合成甲醇液体的热化学方程式____。
(2)已知:CO2 (g)+3H2 (g)=CH3OH (g)+H2O(g) △H=- 49.0kJ/mol,将6molCO2和8mol H2充入4L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线),图中数据a(l,6)表示在1min时H2的物质的量是6mol。

①b点正反应速率____(填“大于”“等于”或“小于”)逆反应速率。此温度下该反应的平衡常数为____。
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅱ对应的实验条件改变是____,体积不变再充入3 mol CO2和4mol H2,H2O(g)的体积分数____(填“增大”“不变”或“减小”)
Ⅱ.粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)
(1)铅蓄电池的负极电极反应式为 ___。
(2)粗镍提纯的阴极反应式为 ___。电解结束后,阳极附近产生的沉淀物的主要成分为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com