
 A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,丁加热后可生成甲.各种物质间的转化关系如图:
A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,丁加热后可生成甲.各种物质间的转化关系如图:分析 A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2;甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可甲能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,丁加热后可生成水和氧化铝,符合转化关系.
解答 解:A、B、C是单质,其中A是常见的活泼金属,B和C都是无色气体,常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2;甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可甲能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,丁加热后可生成水和氧化铝,则:
(1)由上述分析可知,A为Al,B为O2,乙是NaAlO2,丁是Al(OH)3;
故答案为:Al;O2;NaAlO2;Al(OH)3;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②乙溶液中通入过量CO2反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语与氧化还原反应等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,Al与碱的特殊的反应是推断的关键.


科目:高中化学 来源: 题型:解答题
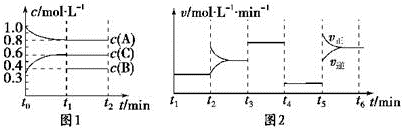
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
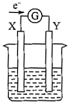 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn | |
| C. | 若两电极都是金属,则它们的活动性为X>Y | |
| D. | X极上发生的是还原反应,Y极上发生的氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) | |
| B. | 用0.100 0 mol•L-1NaOH滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1现象说明该反应为放热反应 | |
| B. | 图2中b点的操作是压缩注射器 | |
| C. | c点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com