
| ��ѧ�� | N��N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| ʵ���� | �¶� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
| N��SO2�� | N��NO2�� | N��NO�� | ||
| �� | T1 | 0.80 | 0.20 | 0.18 |
| �� | T2 | 0.20 | 0.80 | 0.16 |
| �� | T3 | 0.20 | 0.30 | a |

���� ��1����ѧ�ϣ��涨��״�����ȶ����ʵ�������Ϊ0���������ʵ������ȣ�NH3��g��ΪmkJ•mol-1��H2O��l��ΪnkJ•mol-1����Ӧ�ġ�H=�����������֮��-��Ӧ���������֮�ͣ���Ӧ�ʱ��H=��Ӧ���ܼ���-�������ܼ��ܣ�
��2���ٸ��ݷų��������������Ķ����������ʵ������ٸ���v=$\frac{��c}{��t}$����v��SO2����
��ƽ��ʱNOΪa mol����ʾ���μӷ�Ӧ�������������ʵ����������������������ת���ʣ�
���ټ�����ʵ��ƽ�ⳣ������ϼ���ƽ�ⳣ���ж��¶ȸߵͣ�
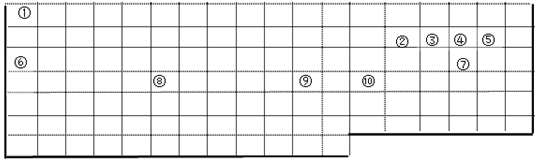
��3��N2O4��g���T2NO2��g����H=+57kJ•mol-1���÷�ӦΪ���ȷ�Ӧ�������¶ȣ���ѧƽ�������ƶ���NO2�����������������ѹǿ����ѧƽ�������ƶ���NO2�����������С�����ͼ�����������
a��A��C���㶼�ڵ������ϣ�ѹǿԽ��Ӧ����Խ�죻
b������ѹǿƽ�����淴Ӧ���У����淴Ӧ�����Ǽ�С����ѹǿ������Ũ���������ƣ�������ƽ���Ա�ԭƽ��Ũ�ȴ�
c��ѹǿ��ͬ�������¶ȣ���ѧƽ�������ƶ���NO2�������������A��NO2�����������
d��ƽ�ⳣ�����¶ȱ仯���ݴ��жϣ�
��4�����ݷ����ĵ缫��Ӧ������֪����������������ʯī�缫�����������ݵ���������ӵķŵ�˳���Լ��缫��Ӧ�͵��ӵ�ת��֪ʶ���شɣ�
��� �⣺��1��2N2��g��+6H2O��l���T4NH3��g��+3O2��g�����涨��״�����ȶ����ʵ�������Ϊ0���������ʵ������ȣ�NH3��g��ΪmkJ•mol-1��H2O��l��ΪnkJ•mol-1����Ӧ�ġ�H=�����������֮��-��Ӧ���������֮��=��4m-6n��KJ/mol��
��4m-6n��KJ/mol=��2a+12b-12d-3c��KJ/mol��
H-N���ļ���Ϊd=$\frac{2a+12b-3c-4m+6n}{12}$��
�ʴ�Ϊ��4m-6n�� $\frac{2a+12b-3c-4m+6n}{12}$��
��2����ʵ����У���2minʱ��÷ų���������4.2kJ�������Ķ����������ʵ���Ϊ$\frac{4.2KJ}{42KJ/mol}$=0.1mol����v��SO2��=$\frac{\frac{0.1mol}{1L}}{2min}$=0.05mol/��L��min����
�ʴ�Ϊ��0.05mol/��L��min����
��ʵ����У�ƽ��ʱNOΪa mol����μӷ�Ӧ�������������ʵ���Ϊamol��
SO2��g��+NO2��g��?SO3��g��+NO��g��
��ʼ����mol����0.2 0.3 0 0
�仯����mol����a a a a
ƽ������mol����0.2-a 0.3-a a a
�ʶ���������ת����Ϊ$\frac{amol}{0.3mol}$��100%=$\frac{10a}{3}$��100%��
�ʴ�Ϊ��$\frac{10a}{3}$��100%��
����ʵ��ƽ��ʱ��NOΪ0.16mol����
SO2��g��+NO2��g��?SO3��g��+NO��g��
��ʼ����mol����0.2 0.8 0 0
�仯����mol����0.16 0.16 0.16 0.16
ƽ������mol����0.04 0.64 0.16 0.16
T2�¶���ƽ�ⳣ��K=$\frac{c��S{O}_{3}��c��NO��}{c��S{O}_{2}��c��N{O}_{2}��}$=$\frac{0.16��0.16}{0.04��0.64}$=1��
����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С����T1��T2��
�ʴ�Ϊ������
��3��a����ͼ���֪��A��C���㶼�ڵ������ϣ�C��ѹǿ����A��C����ķ�Ӧ���ʣ�A��C����a����
b����ͼ���֪��A��C���㶼�ڵ������ϣ�C��ѹǿ����A���C��ƽ�����淴Ӧ���У����淴Ӧ���������ڼ�С�������ѹǿ��ƽ���ƶ��Ľ������NO2Ũ���������ƣ�������ƽ���Ա�ԭƽ��Ũ�ȴ�ƽ��ʱNO2Ũ�ȱ�A��Ũ�ȸߣ�NO2Ϊ����ɫ���壬��A��C�����������ɫ��Adz��C���b����
c�������¶ȣ���ѧƽ�������ƶ���NO2���������������ͼ���֪��A��NO2�������������T1��T2����״̬A��״̬B�������ý��µķ�������c����
d����ͼ���֪��A��C���㶼�ڵ������ϣ��¶Ȳ���ƽ�ⳣ�����䣬A��C����Ļ�ѧƽ�ⳣ����A=C����d��ȷ��
��ѡd��
�ʴ�Ϊ��d��
��4���ٸ��ݷ����ĵ缫��Ӧ������֪�����������������ӵ�Դ�ĸ������ʴ�Ϊ��������
�ھ�������ԭ��Ӧ��ԭ�����䷴Ӧ����ʽΪ3Cl2+2CNO-+8OH-�TN2+6Cl-+2CO32-+4H2O���ʴ�Ϊ��N2��
�������������ӷŵ緢����ԭ��Ӧ��������������������������Ӧ�������ĵ缫��ӦʽΪ��CN--2e-+2OH-�TCNO-+H2O��2Cl--2e-�TCl2����
�ʴ�Ϊ��CN--2e-+2OH-=CNO-+H2O��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ���ʡ�ƽ�ⳣ������ѧƽ��ͼ��ȣ���ȷ��������Ի�ѧƽ���Ӱ�켰ͼ�����ݺ�����ĺ��塢����һ��������ȹ���ƽ��ԭ�ɽ�𣬲��ؿ���ѧ����������������ע���ƽ�ⳣ�����������գ��Ѷ��еȣ�


 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�찲��ʡ��ɽ�и������¿�����ѧ���������棩 ���ͣ�ѡ����
����ʵ�鷽����װ����ȷ���ǣ� ��

A. ��ͼ1��ʾװ����ȡ��ϩ
B. ��ͼ2��ʾ������֤HCl����������ˮ
C. ��ͼ3��ʾ����̽�����������Է�Ӧ���ʵ�Ӱ��
D. ��ͼ4��ʾ����������������NaOH����Һ���Ȳ�����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ұ���������������ϩ�ķ�Ӧ��
�ұ���������������ϩ�ķ�Ӧ��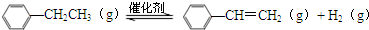
��ѧ�� | C-H | C-C | C=C | H-H |
| ����/kJ•mol��1 | 412 | 348 | 612 | 436 |
| ʱ��/min | 0 | 10 | 20 | 30 | 40 |
| ��ѹǿ/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n��HI��/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.5mol/L | B�� | 2.0mol/L | C�� | 1mol/L | D�� | 2.5mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �˷�Ӧ���κ��¶��¶����Է����� | |
| B�� | �˷�Ӧ���ڵ������Է����� | |
| C�� | �˷�Ӧ���ڸ������Է����� | |
| D�� | �˷�Ӧ���κ��¶��¶������Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com