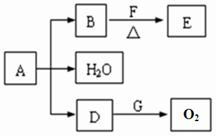
解:(1)D(CO
2)跟G(Na
2O
2)反应的化学方程为:2Na
2O
2+2CO
2=2Na
2CO
3+O
2;故答案为:2Na
2O
2+2CO
2=2Na
2CO
3+O
2(2)B(CuO)和F(C
2H
5OH)在加热条件下反应生成E(CH
3CHO)醇去氢氧化反应,
反应的化学方程式为:CH
3CH
2OH+CuO

CH
3CHO+H
2O+Cu,故答案为:CH
3CH
2OH+CuO

CH
3CHO+H
2O+Cu;
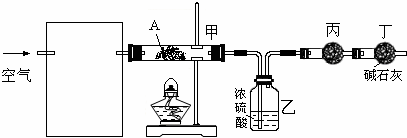
(3)过测定装置甲和乙中试剂的质量变化,探究A的化学式:
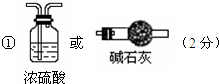
①为使数据准确需要把通入的空气中的水蒸气除去,以免影响测定结果;装置为
故答案为:
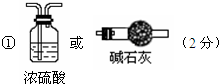
②向装置中鼓入空气的目的是,将A分解产生的水蒸气送入盛有浓硫酸的洗气瓶中;丙装置中药品的名称是无水硫酸铜,作用是检查水蒸气是否除净;无变化证明水蒸气除净,A分解产生的水蒸气全部被浓硫酸吸收;
故答案为:将A分解产生的水蒸气送入盛有浓硫酸的洗气瓶中;无水硫酸铜;A分解产生的水蒸气全部被浓硫酸吸收;
③判断A已完全分解的方法为,连续两次加热、鼓气、冷却,称量甲装置的质量,质量差不超过0.1 g,证明A分解完全;故答案为;连续两次加热、鼓气、冷却,称量甲装置的质量,质量差不超过0.1 g,证明A分解完全;
④实验测得出如下数据:A受热后完全分解,固体由8.0g变为6.0g,装置乙增重0.9g为生成的水的质量,干燥管中增重1.1g为CO
2.根据原子守恒,8.0gA中含有的氢元素物质的量为
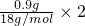
=0.1mol:所含碳元素物质的量为
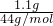
=0.025mol;生成的氧化铜质量为6g;铜物质的量为
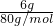
=0.075mol;氧元素的质量为8.0g-0.1mol×1g/mol-0.025mol×12g/mol-0.075mol×64g/mol=2.8g,氧元素物质的量为物质的量为=

=0.175mol;A中元素原子物质的量之比为:
n(Cu):n(C):n(H):n(O)=0.075:0.025:0.1:0.175=3:1:4:7;化学式为Cu
3H
4CO
7;结合反应转化可知,结构中含碳酸根,剩余为氢氧根,写出化学式为:Cu
3(OH)
4CO
3或CuCO
3?2Cu(OH)
2;
故答案为:Cu
3(OH)
4CO
3或CuCO
3?2Cu(OH)
2;
分析:A为绿色粉末,含H、C、O、Cu四种元素证明为铜绿.常温下,D为无色无味气体结合与G反应生成氧气判断D为CO
2;B为黑色粉末推断为CuO,F和E均为有机物,已知F和E的相对分子质量之差等于2.说明EF反应是在氧化铜催化作用下把醇羟基氧化为醛基;F为醇,E为醛;已知A、B、D、E、F、G为中学化学中常见的化合物,所以判断E为CH
3CHO;F为CH
3CH
2OH依据判断物质就分析回答问题;
点评:本题考查了物质转化关系和物质性质的综合应用,实验方案的设计和实验测定的准确操作,化学式的计算判断,实验过程的分析判断,题目难度中等.

 CH3CHO+H2O+Cu,故答案为:CH3CH2OH+CuO
CH3CHO+H2O+Cu,故答案为:CH3CH2OH+CuO CH3CHO+H2O+Cu;
CH3CHO+H2O+Cu;

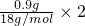 =0.1mol:所含碳元素物质的量为
=0.1mol:所含碳元素物质的量为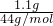 =0.025mol;生成的氧化铜质量为6g;铜物质的量为
=0.025mol;生成的氧化铜质量为6g;铜物质的量为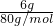 =0.075mol;氧元素的质量为8.0g-0.1mol×1g/mol-0.025mol×12g/mol-0.075mol×64g/mol=2.8g,氧元素物质的量为物质的量为=
=0.075mol;氧元素的质量为8.0g-0.1mol×1g/mol-0.025mol×12g/mol-0.075mol×64g/mol=2.8g,氧元素物质的量为物质的量为= =0.175mol;A中元素原子物质的量之比为:
=0.175mol;A中元素原子物质的量之比为:

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案 则:
则:


 (2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:
(2011?福建模拟)原子序数递增的部分短周期主族元素的原子半径数据如下表:

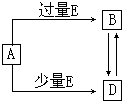 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).