
”¾ĢāÄæ”æŌŚČżøö2 LŗćČŻµÄČŻĘ÷ÖŠ£¬·Ö±š·¢Éś·“Ó¦A£Øg£©+3B£Øg£©![]() 2C£Øg£©£¬5minŗóø÷ČŻĘ÷·“Ó¦“ļĘ½ŗāדĢ¬£¬ĘäÖŠ¼×ČŻĘ÷ÖŠAµÄĪļÖŹµÄĮæĪŖ0.4 mol”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø£©
2C£Øg£©£¬5minŗóø÷ČŻĘ÷·“Ó¦“ļĘ½ŗāדĢ¬£¬ĘäÖŠ¼×ČŻĘ÷ÖŠAµÄĪļÖŹµÄĮæĪŖ0.4 mol”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø£©
·“Ó¦Ē°ø÷ĪļÖŹµÄĪļÖŹµÄĮæ/mol
A | B | C | |
¼× | 1 | 3 | 0 |
ŅŅ | 0 | 0 | 2 |
±ū | 1.5 | 4.5 | 1 |
A.ŅŅÖŠ5minÄŚCµÄ·“Ó¦ĖŁĀŹĪŖ0.16mol-1”¤min-1
B.“ļµ½Ę½ŗāŹ±£¬±ūÖŠAµÄÅØ¶ČŹĒ¼×ÖŠµÄ2±¶
C.±ūÖŠ·“Ó¦µÄĘ½ŗā³£Źż“óÓŚ¼×ÖŠ·“Ó¦µÄĘ½ŗā³£Źż
D.“ļµ½Ę½ŗāŹ±£¬¼×”¢ŅŅĮ½ČŻĘ÷ÖŠCµÄĪļÖŹµÄĮæĻąµČ
”¾“š°ø”æD
”¾½āĪö”æ
ĄūÓƵȊ§Ę½ŗā½ųŠŠ·ÖĪö£»
¼×ČŻĘ÷ÖŠÓ¦A£Øg£©+3B£Øg£©![]() 2C£Øg£©
2C£Øg£©
ĘšŹ¼£Ømol£© 1 3 0
±ä»Æ£Ømol£© 0.6 1.8 1.2
Ę½ŗā£Ømol£© 0.4 1.2 1.2
ŅŅČŻĘ÷ÖŠŗĶ¼×ČŻĘ÷“ļµ½ĻąĶ¬Ę½ŗāדĢ¬
ŅŅČŻĘ÷A£Øg£©+3B£Øg£©![]() 2C£Øg£©
2C£Øg£©
ĘšŹ¼£Ømol£© 0 0 2
±ä»Æ£Ømol£© 1.2 1.2 0.8
Ę½ŗā£Ømol£© 1.2 1.2 1.2
ŗćČŻČŻĘ÷ÖŠ±ūÖŠ“ļµ½Ę½ŗā
A£Øg£©+3B£Øg£©![]() 2C£Øg£©
2C£Øg£©
1.5 4.5 1
ĘšŹ¼ĮææÉŅŌæ“×÷ĪŖ2 6 0£¬Ļąµ±ÓŚ¼×ČŻĘ÷µÄ2±¶£¬øĆ·“Ó¦ĪŖĘųĢåĢå»ż¼õŠ”µÄ·“Ó¦£¬¼“Ń¹ĒæŌö“óĘ½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬
A”¢¼×ČŻĘ÷ŗĶŅŅČŻĘ÷“ļµ½ĻąĶ¬µÄĘ½ŗāדĢ¬£¬ŅĄ¾Ż·ÖĪöæÉÖŖÓ¦ĻūŗÄCµÄĪļÖŹµÄĮæĪŖ0.8mol£¬ŅŅÖŠ5minÄŚCµÄ·“Ó¦ĖŁĀŹĪŖ![]() =0.08mol/(L”¤min)£¬¹ŹA“ķĪó£»
=0.08mol/(L”¤min)£¬¹ŹA“ķĪó£»
B”¢±ūČŻĘ÷ÖŠµÄĘšŹ¼ĮæĻąµ±ÓŚ¼×ČŻĘ÷µÄ2±¶£¬µ«øĆ·“Ó¦ĪŖĘųĢåĢå»ż¼õŠ”£¬Ń¹ĒæŌö“óĘ½ŗāĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬Ōņ±ūÖŠAµÄÅØ¶Č±Č¼×ČŻĘ÷ÖŠµÄ2±¶Š”£¬¹ŹB“ķĪó£»
C”¢»ÆŃ§Ę½ŗā³£ŹżÖ»ŹÜĪĀ¶ČµÄÓ°Ļģ£¬¼×ŗĶ±ūČŻĘ÷ĪĀ¶ČĻąĶ¬£¬¼“»ÆŃ§Ę½ŗā³£Źż²»±ä£¬¹ŹC“ķĪó£»
D”¢øł¾ŻÉĻŹö·ÖĪö£¬“ļµ½Ę½ŗāŹ±£¬¼×ŅŅČŻĘ÷ÖŠCµÄĪļÖŹµÄĮæĻąµČ£¬¹ŹDÕżČ·£»
“š°øŃ”D”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆѧÓĆÓļ»ņĆū³Ę±ķŹö²»ÕżČ·µÄŹĒ£Ø £©
A.ĘĻĢŃĢĒµÄ·Ö×ÓŹ½£ŗC6H12O6
B.HClµÄµē×ÓŹ½£ŗ![]()
C. µÄĆū³Ę£ŗ2©¼×»ł±ūĶé
µÄĆū³Ę£ŗ2©¼×»ł±ūĶé
D.ŗ¬ÓŠ10øöÖŠ×ÓµÄŃõŌ×ÓæɱķŹ¾ĪŖ£ŗ![]() O
O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×éĶ¬Ń§ĶعżŹµŃéŃŠ¾æFeCl3ČÜŅŗÓėCu·Ū·¢ÉśµÄŃõ»Æ»¹Ō·“Ó¦”£ŹµŃé¼ĒĀ¼ČēĻĀ£ŗ
ŠņŗÅ | I | II | III |
ŹµŃé²½Öč |
³ä·ÖÕńµ“£¬¼ÓČė2mLÕōĮóĖ® |
³ä·ÖÕńµ“£¬¼ÓČė2mLÕōĮóĖ® |
³ä·ÖÕńµ“£¬¼ÓČė2mLÕōĮóĖ® |
ŹµŃéĻÖĻó | Ķ·ŪĻūŹ§£¬ČÜŅŗ»ĘÉ«±äĒ³£¬¼ÓČėÕōĮóĖ®ŗóĪŽĆ÷ĻŌĻÖĻó | Ķ·ŪÓŠŹ£Óą£¬ČÜŅŗ»ĘÉ«ĶŹČ„£¬¼ÓČėÕōĮóĖ®ŗóÉś³É°×É«³Įµķ | Ķ·ŪÓŠŹ£Óą£¬ČÜŅŗ»ĘÉ«ĶŹČ„£¬±ä³ÉĄ¶É«£¬¼ÓČėÕōĮóĖ®ŗóĪŽ°×É«³Įµķ |
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ŹµŃéI”¢II”¢IIIÖŠ¾łÉę¼°Fe3+±»»¹Ō
B. ¶Ō±ČŹµŃéI”¢IIĖµĆ÷°×É«³ĮµķµÄ²śÉśÓėĶ·ŪµÄĮæÓŠ¹Ų
C. ŹµŃéII”¢IIIÖŠ¼ÓČėÕōĮóĖ®ŗóc(Cu2+)ĻąĶ¬
D. ĻņŹµŃéIII·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČė±„ŗĶNaClČÜŅŗæÉÄܳöĻÖ°×É«³Įµķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆNA±ķŹ¾°¢·üµĀĀŽ³£Źż£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ £Ø £©
A.±ź×¼×“æöĻĀ£¬22.4L CCl4ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ1NA
B.Ķس£×“æöĻĀ£¬NAøöCO2·Ö×ÓÕ¼ÓŠµÄĢå»żĪŖ22.4L
C.³£ĪĀ³£Ń¹ĻĀ£¬1.06g Na2CO3ČÜÓŚĖ®£¬ČÜŅŗÖŠŗ¬Na+Ąė×ÓŹżĪŖ0.02NA
D.ÅضČĪŖ0.5mol/LµÄMgCl2ČÜŅŗÖŠ£¬ŗ¬ÓŠClŹżĪŖNAøö
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄš¾ĘŗĶŌģ“׏Ē¹Å“śĄĶ¶ÆČĖĆńµÄÖĒ»Ū½į¾§£¬°×¾ĘŗĶ“×Ņ²ŹĒČÕ³£Éś»īÖŠ³£¼ūµÄÓŠ»śĪļ”£
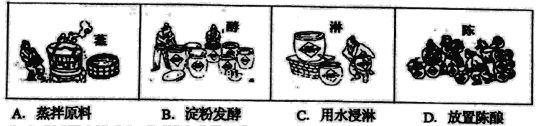
(1)ÉĻŹöŅŌøßĮ»ĪŖÖ÷ŅŖŌĮĻµÄÄš“×¹¤ŅÕÖŠ£¬ĄūÓĆ“×ĖįČܽāŠŌµÄŹĒ_________(ĢīŃ”Ļī)”£
(2)Š“³öŅŅĖįŌŚĖ®ČÜŅŗÖŠµÄµēĄėĘ½ŗā³£ŹżµÄ±ķ“ļŹ½________”£
(3)ŅŃÖŖ25”ęĻĀ£¬CH3COOHŌŚĖ®ÖŠµēĄėµÄµēĄė³£ŹżKa£½2”Į10£5£¬Ōņ25”ꏱCH5COONaĖ®½āĘ½ŗā³£ŹżKh£½_________(ĢīŹżÖµ)”£
(4)½üÄźĄ“£¬ŃŠ¾æÕߥūÓĆŅŅĖįæŖ·¢³öŠĀ¹¤ŅÕŗĻ³ÉŅŅĖįŅŅõ„£¬Ź¹²śĘ·³É±¾Ć÷ĻŌ½µµĶ£¬ĘäÖ÷ŅŖ·“Ó¦ĪŖ£ŗ CH2£½CH2 (g)£«CH3COOH(l) ![]() CH3COOC2H5(l)”£
CH3COOC2H5(l)ӣ
¢ŁøĆ·“Ó¦ŹōÓŚÓŠ»ś·“Ó¦ĄąŠĶÖŠµÄ___________”£
¢ŚĻĀĮŠĆčŹöÄÜĖµĆ÷ŅŅĻ©ÓėŅŅĖįŗĻ³ÉŅŅĖįŅŅõ„µÄ·“Ó¦ŅŃ“ļ»ÆŃ§Ę½ŗāµÄŹĒ_________(ĢīŃ”Ļī)”£
A ŅŅĻ©”¢ŅŅĖį”¢ŅŅĖįŅŅõ„µÄÅضČĻąĶ¬
B õ„»ÆŗĻ³É·“Ó¦µÄĖŁĀŹÓėõ„·Ö½ā·“Ó¦µÄĖŁĀŹĻąµČ
C ŅŅĻ©¶ĻæŖl molĢ¼Ģ¼Ė«¼üµÄĶ¬Ź±ŅŅĖįĒ”ŗĆĻūŗÄl mol
D ĢåĻµÖŠŅŅĖįµÄ°Ł·Öŗ¬ĮæŅ»¶Ø
(5)ĻĀĶ¼ĪŖn(ŅŅĻ©)Óėn(ŅŅĖį)ĪļĮĻ±ČĪŖ1Ź±£¬ŌŚ²»Ķ¬Ń¹ĒæĻĀ½ųŠŠĮĖŅŅĖįŅŅõ„µÄ²śĀŹĖęĪĀ¶Č±ä»ÆµÄ²ā¶ØŹµŃ飬ŌŚĻąĶ¬Ź±¼äµćµÄŹµŃé½į¹ūČēĶ¼ĖłŹ¾”£»Ų“šĻĀĮŠĪŹĢā£ŗ
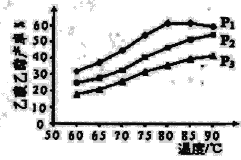
¢ŁĪĀ¶ČŌŚ60£80”ę·¶Ī§ÄŚ£¬ŅŅĻ©ÓėŅŅĖįõ„»ÆŗĻ³É·“Ó¦ĖŁĀŹÓɓ󵽊”µÄĖ³ŠņŹĒ_______[ÓĆv(P1)”¢v(P2)”¢v(P3)·Ö±š±ķŹ¾²»Ķ¬Ń¹ĒæĻĀµÄ·“Ó¦ĖŁĀŹ]”£
¢ŚŃ¹ĒæĪŖP1 MPa”¢ĪĀ¶Č60”ꏱ£¬ČōŅŅĖįŅŅõ„µÄ²śĀŹĪŖ30%£¬Ōņ“ĖŹ±ŅŅĻ©µÄ×Ŗ»ÆĀŹĪŖ_______”£
¢ŪŃ¹ĒæĪŖP1 MPa”¢ĪĀ¶Č³¬¹ż80”ꏱ£¬ŅŅĖįŅŅõ„²śĀŹĻĀ½µµÄŌŅņæÉÄÜŹĒ___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĖłŃ§ÖŖŹ¶Ķź³ÉĢāÄæ£ŗ
(1)ÓƵ„ĻßĒűķŹ¾ĻĀĮŠ·“Ó¦ÖŠµē×Ó×ŖŅĘ·½ĻņŗĶŹżÄæ£ŗKIO3+5KI+3H2SO4ØT3K2SO4+3I2+3H2O_____
(2)øĘŌŖĖŲŹĒČĖĢå±ŲŠčµÄ³£ĮæŌŖĖŲ£¬ĖłÓŠµÄĻø°ū¶¼ŠčŅŖøĘŌŖĖŲ£®²ā¶ØČĖĢåŃŖŅŗÖŠøĘŌŖĖŲµÄŗ¬Įæ³£ÓƵ½ČēĻĀĮ½øö·“Ó¦£ŗ¢ŁCaC2O4+H2SO4=H2C204+CaSO4¢Ś2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2”ü+8H2O£¬ÉĻŹö·“Ó¦¢ŚµÄ»¹Ō¼ĮŹĒ___£»ČōŹÕ¼Æµ½44.8mL£Ø±ź×¼×“æö£©µÄCO2Ź±£¬ĻūŗÄŃõ»Æ¼Į___mol£¬ÓŠ__molµē×Ó·¢Éś×ŖŅĘ£¬Ļąµ±ÓŚ²ā³öŗ¬øĘŌŖĖŲµÄÖŹĮæŹĒ__g”£
(3)ŹŖ·ØÖʱøøßĢśĖį¼Ų(K2FeO4)µÄ·“Ó¦ĢåĻµÖŠÓŠĮłÖÖĪ¢Į££ŗFe(OH)3”¢ClO£”¢OH£”¢FeO42-”¢Cl£”¢H2O”£Š“³ö¼īŠŌĢõ¼žĻĀÖĘøßĢśĖį¼ŲµÄĄė×Ó·“Ó¦·½³ĢŹ½£ŗ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·ś»ÆøõæÉÓĆ×÷Ć«ÖÆĘ··ĄÖū¼Į”¢Ā±»Æ“߻ƼĮ”¢“óĄķŹÆÓ²»Æ¼°×ÅÉ«¼Į”£ŅŌøõŌĘÄøæóŹÆ(ŗ¬4.5%Cr2O3,»¹ŗ¬Fe2O3”¢FeO”¢MgO”¢SiO2)ĪŖŌĮĻÖʱø·ś»ÆøõµÄ¹¤ŅÕĮ÷³ĢČēĻĀ”£
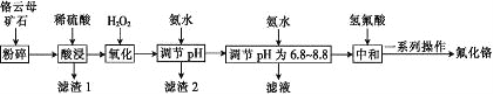
ĻĀ±ķĮŠ³öĮĖĻą¹Ų½šŹōĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH:
ĒāŃõ»ÆĪļ | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
æŖŹ¼³ĮµķµÄpH | 2.3 | 8.8 | 4.9 | 7.5 |
³ĮµķĶźČ«µÄpH | 4.1 | 10.4 | 6.8 | 9.7 |
Ēė»Ų“šĻĀĮŠĪŹĢā:
(1)½«øõŌĘÄøæóŹÆ·ŪĖéµÄÄæµÄŹĒ___________”£
(2)Cr2O3ÓėĻ”ĮņĖį·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ________________”£
(3)µŚŅ»“ĪµĪ¼Ó°±Ė®µ÷½ŚpH·¶Ī§ĪŖ______”£
(4)µŚ¶ž“ĪµĪ¼Ó°±Ė®µ÷½ŚpH ĪŖ6.8~8.8µÄÄæµÄŹĒ___________,Cr(OH)3Óė Al(OH)3 Ņ»Ńł¾ßÓŠĮ½ŠŌ£¬ČōµŚ¶ž“ĪµĪ¼ÓµÄ°±Ė®øÄĪŖNaOHČÜŅŗ£¬Éś³ÉµÄCr(OH)3»į²æ·ÖČܽā£¬Š“³öCr(OH)3ČܽāµÄĄė×Ó·½³ĢŹ½:___________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠAl”¢Cl2”¢Al2O3”¢HCl(aq)”¢Al(OH)3”¢NaOH(aq)ĮłÖÖĪļÖŹ£¬ĖüĆĒÖ®¼äÓŠČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ¹ŲĻµ£¬Ķ¼ÖŠĆæĢõĻßĮ½¶ĖµÄĪļÖŹÖ®¼ä¶¼æÉŅŌ·¢Éś·“Ó¦£¬ĻĀĮŠĶʶĻ²»ŗĻĄķµÄŹĒ£Ø £©
![]()
A.XæÉÄÜĪŖAl»ņCl2
B.YŅ»¶ØĪŖNaOH(aq)
C.NŅ»¶ØŹĒHCl(aq)
D.Q”¢ZÖŠµÄŅ»ÖÖ±ŲĪŖAl2O3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌ·Ļ¾ÉŠæĆĢµē³ŲÖŠµÄŗŚĆĢ·Ū£ØMnO2”¢MnO£ØOH£©”¢NH4Cl”¢ÉŁĮæZnCl2¼°ĢæŗŚ”¢Ńõ»ÆĢśµČ£©ĪŖŌĮĻÖʱøMnCl2£¬ŹµĻÖĆĢµÄŌŁĄūÓĆ”£Ę乤×÷Į÷³ĢČēĻĀ£ŗ
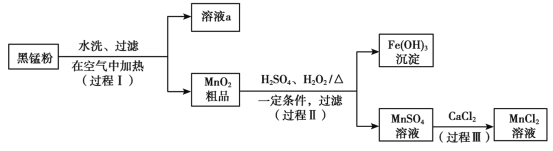
£Ø1£©¹ż³Ģ¢ńÖŠ£¬ŌŚæÕĘųÖŠ³ä·Ö¼ÓČČŗŚĆĢ·ŪµÄÄæµÄÖ÷ŅŖŹĒ³żČ„__________ŗĶŃõ»ÆĆĢŌŖĖŲ£¬ĒėŠ“³öŗ¬MnŌŖĖŲµÄĪļÖŹ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½____________________________”£
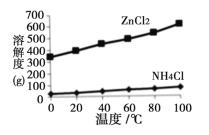
£Ø2£©ČÜŅŗaµÄÖ÷ŅŖ³É·ÖĪŖNH4Cl£¬ĮķĶā»¹ŗ¬ÓŠÉŁĮæZnCl2µČ”£øł¾ŻÓŅĶ¼ĖłŹ¾µÄČܽā¶ČĒśĻߣ¬½«ČÜŅŗa¾___________”¢_______________”¢¹żĀĖæɵĆNH4Cl“ÖĘ·”£
£Ø3£©¼ģŃéMnSO4ČÜŅŗÖŠŹĒ·ńŗ¬ÓŠFe3£«£ŗȔɣĮæČÜŅŗ£¬¼ÓČė____________£ØĢīŹŌ¼ĮŗĶĻÖĻ󣩣¬Ö¤Ć÷ČÜŅŗÖŠFe3£«³ĮµķĶźČ«”£
£Ø4£©Ģ½¾æ¹ż³Ģ¢ņÖŠMnO2ČܽāµÄŹŹŅĖĢõ¼ž”£
¢”.ĻņMnO2ÖŠ¼ÓČėH2O2ČÜŅŗ£¬²śÉś“óĮæĘųÅŻ£»ŌŁ¼ÓČėĻ”H2SO4£¬¹ĢĢåĪ“Ć÷ĻŌČܽā”£
¢¢.ĻņMnO2ÖŠ¼ÓČėĻ”H2SO4£¬¹ĢĢåĪ“Čܽā£»ŌŁ¼ÓČėH2O2ČÜŅŗ£¬²śÉś“óĮæĘųÅŻ£¬¹ĢĢåĶźČ«Čܽā”£
¢ŁÓĆ»Æѧ·½³ĢŹ½±ķŹ¾¢¢ÖŠMnO2ČܽāµÄŌŅņ£ŗ__________________”£
¢Ś½āŹĶŹŌ¼Į¼ÓČėĖ³Šņ²»Ķ¬£¬MnO2×÷ÓĆ²»Ķ¬µÄŌŅņ£ŗ_______________________”£
ÉĻŹöŹµŃéĖµĆ÷£¬ŹŌ¼Į¼ÓČėĖ³Šņ²»Ķ¬£¬ĪļÖŹĢåĻֵĊŌÖŹæÉÄܲ»Ķ¬£¬²śĪļŅ²æÉÄܲ»Ķ¬”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com