
 A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:
A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:分析 A是易溶于水的有机物,能与Na、乙酸反应,含有-OH,发生催化氧化得到D,D的相对分子质量为44,D分子中碳原子数目只能为2,可推知D为CH3CHO,A为CH3CH2OH,乙醇与乙酸发生酯化反应得到C为CH3COOCH2CH3,与钠发生取代反应生成乙醇钠与氢气,完全燃烧发生氧化反应得到二氧化碳与水,以此来解答.
解答 解:A是易溶于水的有机物,能与Na、乙酸反应,含有-OH,发生催化氧化得到D,D的相对分子质量为44,D分子中碳原子数目只能为2,可推知D为CH3CHO,A为CH3CH2OH,乙醇与乙酸发生酯化反应得到C为CH3COOCH2CH3,与钠发生取代反应生成乙醇钠与氢气,完全燃烧发生氧化反应得到二氧化碳与水,
(1)反应①为取代反应、反应②、④为氧化反应、反应③为酯化反应,
故答案为:③;
(2)由上述分析可知,有机物C的结构简式为CH3COOCH2CH3,
故答案为:CH3COOCH2CH3;
(3)反应④的化学方程式为2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O.
点评 本题考查有机物的推断,为高频考点,把握A、D及官能团的变化、有机物的性质及反应为解答的关键,侧重分析与推断能力的考查,注意利用D的相对分子质量确定含有碳原子数目,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
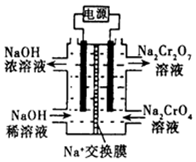 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 | |
| B. | Fe(OH)3胶体的胶粒带正电荷,通电时胶粒向直流电源的负极移动,这种现象称为电泳 | |
| C. | 向沸腾蒸馏水逐滴加饱和FeCl3溶液,至液体呈透明红褐色时即得到Fe(OH)3胶体 | |
| D. | 向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅动,然后继续煮沸,制备Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com