
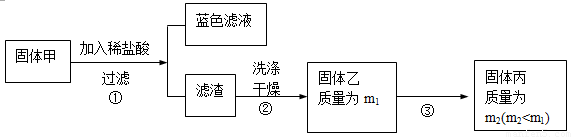
ij��ȤС��ͬѧȡ��80.00 g��MgCl2��Һ(��þԪ����������Ϊ15.00%)������С�����ɵ�49.25 g����(��ɷֱ�ʾΪMgx(OH)yClz•nH2O)��Ϊ�о�����ɽ�����������ʵ�飺
ʵ��һ�������ù���ȫ������100 mL 1.50 mol��L��1�������У��ټ�ˮϡ����500 mL�������Һ��c(H+)=0.1mol��L��1��
ʵ�����ȡʵ��һϡ�ͺ����Һ50 mL�����м���������AgNO3��Һ�ó���12.915 g��
�ٶ�����������ʵ��İ��ţ�˵����ȷ���� ��������ĸ��ţ�
A����Ҫ�������������� B������Ҫ���������Ѿ��㹻 C��ֻҪ��ʵ��һ����
����ͨ������ȷ������Ļ�ѧʽ����Ҫ���м�����̣�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
| ||
| ʵ������ | ԭ�� |
| ��Һ�������ɫ��Ϊ �� �� ɫ |
������ˮ��Ӧ���ɵ�H+ʹʯ���ɫ |
| �����Һ��Ϊ��ɫ | ������ˮ��Ӧ���ɵ�HClO��ʯ������Ϊ��ɫ���� ������ˮ��Ӧ���ɵ�HClO��ʯ������Ϊ��ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2009?�ع�һģ��ij��ȤС��ͬѧΪ֤��NaOH��Һ��ϡ���ᷢ�����кͷ�Ӧ���Ӳ�ͬ�Ƕ����������ʵ�鷽����������ʵ�飮
��2009?�ع�һģ��ij��ȤС��ͬѧΪ֤��NaOH��Һ��ϡ���ᷢ�����кͷ�Ӧ���Ӳ�ͬ�Ƕ����������ʵ�鷽����������ʵ�飮 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| ��� | ���� | NaOH��Һ | ��t/�� |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
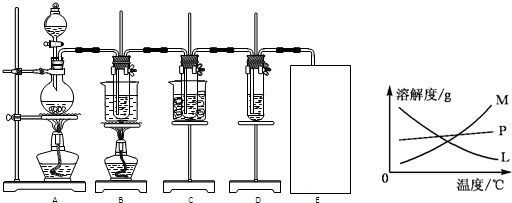
Ϊ̽��ͭ��Ũ����ķ�Ӧ��ij��ȤС�����������ʵ�顣
��ʵ��1��ͭ��Ũ���ᷴӦ��ʵ��װ����ͼ��ʾ��
(1)��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ��
(2)��Ϩ��ƾ��ƺ���Ϊ�е��ܴ��ڣ�B�е�Һ�岻�ᵹ������ԭ���ǣ� ��
���װ��ǰ����������Ϊ��ʹװ���еIJ���������ȫ�����գ�Ӧ����ȡ�IJ����ǣ� ��
��ʵ��2��ʵ���з����Թ��ڳ��˲�����ɫ�����⣬��ͭ˿���滹�к�ɫ��������ɣ����п��ܺ�������ͭ��������ͭ����ͭ������ͭ��
�������ϣ�
��������ͭ�����Ի����»ᷢ������������ԭ��Ӧ����Cu2+��ͭ���ʣ��ڿ����г�����գ�����ת��Ϊ����ͭ��
����ͭ������ͭ�����¶�������ϡ���ᣬ�ڿ����г�����գ���ת��Ϊ����ͭ�Ͷ�������
Ϊ���о��ijɷ֣���С��ͬѧ���ռ����㹻���Ĺ������������ʵ�飺
(3)��������м��������Ƿ�ϴ�Ӹɾ���ʵ�鷽���ǣ� ��
(4)���������ڿ���������ʱ��ʹ�õ�ʵ���������˲����������żܡ��ƾ����⣬�������У�
��
(5)��ȷ�����Ƿ�������ȫ�IJ����ǣ� ��
(6)�����չ�����һ�������Ļ�ѧ��Ӧ����ʽΪ�� ��
������泥�NH4ClO4���Ǹ��ϻ���ƽ�������Ҫ�ɷ֣�ʵ���ҿ�ͨ�����з�Ӧ��ȡ��
��������NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
(7)���ð�����Ũ�������NH4Cl��������Ӧ����Ҫ��繩�Ⱦ��ܽ��У���ԭ����:
��
(8)����Ӧ�õ��Ļ����Һ��NH4ClO4��NaCl�����������ֱ�Ϊ0.30��0.l5��������ʵ��ܽ����������ͼ�����ӻ����Һ�л�ý϶�NH4ClO4�����ʵ���������Ϊ����������ƣ�����Ũ���� �����ˣ� �����
Ϊ�˲ⶨ��Ʒ��NH4ClO4�ĺ�����װ������ͼ��ʾ������װ�á������̶�װ������ȥ����ʵ�鲽�����£�
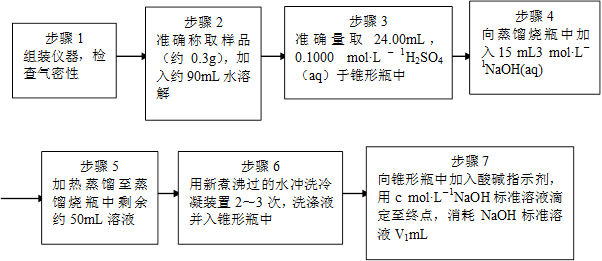
(9)������3�У�ȷȡ��24.00 mL H2SO4(aq)�IJ��������� ��
(10)��ʵ����ȷ�����ɵİ���ϡ������ȫ���յ�ʵ�鲽���� ����д�����ţ���
(11)�������ظ�ʵ��2~3�Σ���ԭ���� ��
(12)�����0.320 g�����к�NH4ClO4��ȷֵΪ0.095g����ʵ��ⶨ�����0.092g ����ʵ��
��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���Ϻ���������������ѧ����ĩ������⻯ѧ�Ծ� ���ͣ�ʵ����
Ϊ̽��ͭ��Ũ����ķ�Ӧ��ij��ȤС�����������ʵ�顣
��ʵ��1��ͭ��Ũ���ᷴӦ��ʵ��װ����ͼ��ʾ��

(1)��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ��
(2)��Ϩ��ƾ��ƺ���Ϊ�е��ܴ��ڣ�B�е�Һ�岻�ᵹ������ԭ���ǣ� ��
���װ��ǰ����������Ϊ��ʹװ���еIJ���������ȫ�����գ�Ӧ����ȡ�IJ����ǣ� ��
��ʵ��2��ʵ���з����Թ��ڳ��˲�����ɫ�����⣬��ͭ˿���滹�к�ɫ��������ɣ����п��ܺ�������ͭ��������ͭ����ͭ������ͭ��
�������ϣ�
��������ͭ�����Ի����»ᷢ������������ԭ��Ӧ����Cu2+��ͭ���ʣ��ڿ����г�����գ�����ת��Ϊ����ͭ��
����ͭ������ͭ�����¶�������ϡ���ᣬ�ڿ����г�����գ���ת��Ϊ����ͭ�Ͷ�������
Ϊ���о��ijɷ֣���С��ͬѧ���ռ����㹻���Ĺ������������ʵ�飺
(3)��������м��������Ƿ�ϴ�Ӹɾ���ʵ�鷽���ǣ� ��
(4)���������ڿ���������ʱ��ʹ�õ�ʵ���������˲����������żܡ��ƾ����⣬�������У�
��
(5)��ȷ�����Ƿ�������ȫ�IJ����ǣ� ��
(6)�����չ�����һ�������Ļ�ѧ��Ӧ����ʽΪ�� ��
������泥�NH4ClO4���Ǹ��ϻ���ƽ�������Ҫ�ɷ֣�ʵ���ҿ�ͨ�����з�Ӧ��ȡ��
��������NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)���ð�����Ũ�������NH4Cl��������Ӧ����Ҫ��繩�Ⱦ��ܽ��У���ԭ����:
��
(8)����Ӧ�õ��Ļ����Һ��NH4ClO4��NaCl�����������ֱ�Ϊ0.30��0.l5��������ʵ��ܽ����������ͼ�����ӻ����Һ�л�ý϶�NH4ClO4�����ʵ���������Ϊ����������ƣ�����Ũ���� �����ˣ� �����

Ϊ�˲ⶨ��Ʒ��NH4ClO4�ĺ�����װ������ͼ��ʾ������װ�á������̶�װ������ȥ����ʵ�鲽�����£�
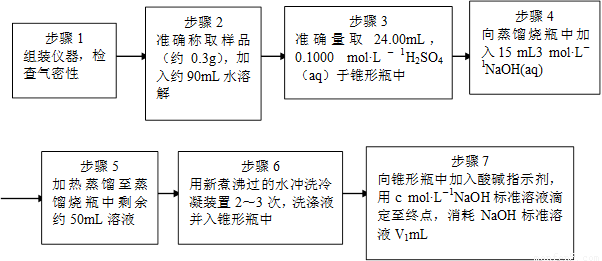
(9)������3�У�ȷȡ��24.00 mL H2SO4(aq)�IJ��������� ��
(10)��ʵ����ȷ�����ɵİ���ϡ������ȫ���յ�ʵ�鲽���� ����д�����ţ���
(11)�������ظ�ʵ��2~3�Σ���ԭ���� ��
(12)�����0.320 g�����к�NH4ClO4��ȷֵΪ0.095g����ʵ��ⶨ�����0.092g ����ʵ��
��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009�긣��ʡ�����и����и߿���ѧģ���Ծ��������棩 ���ͣ������
| ��� | ���� | NaOH��Һ | ��t/�� |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com