
| A. | 向漂白粉浊液中通入过量的CO2 | |
| B. | 向带有氧化膜的铝片中加入盐酸 | |
| C. | 向含有1molCa(HCO3)2的溶液中加入1molNa2O2 | |
| D. | 向含有1molKAl(SO4)2的溶液中加入2molBa(OH)2 |
分析 A.漂白粉的水溶液中通入过量的CO2,反应后滤液中含有碳酸氢钙、次氯酸、氯化钙,加热蒸干时碳酸氢钙、次氯酸受热分解,氯化氢挥发;
B.氧化铝、金属铝均匀盐酸反应氯化铝,溶液中氯化铝水解,加热蒸干时HCl挥发,水解彻底进行,灼烧得到氧化铝;
C.1mol Na2O2和水反应生成2mol氢氧化钠,1molCa(HCO3)2与2molNaOH恰好反应得到碳酸钙、碳酸钠,滤液为碳酸钠溶液;
D.1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2,反应得到2mol硫酸钡沉淀和1mol偏铝酸钾,滤液为偏铝酸钾溶液.
解答 解:A.漂白粉的水溶液中通入过量的CO2,反应后滤液中含有碳酸氢钙、次氯酸、氯化钙,加热蒸干时碳酸氢钙、次氯酸受热分解,氯化氢挥发,残留固体为碳酸钙、氯化钙,故A符合;
B.氧化铝、金属铝均匀盐酸反应氯化铝,溶液中氯化铝水解,加热蒸干时HCl挥发,水解彻底进行得到氢氧化铝,灼烧时氢氧化铝分解得到氧化铝,故B不符合;
C.1mol Na2O2和水反应生成2mol氢氧化钠,1molCa(HCO3)2与2molNaOH恰好反应得到碳酸钙、碳酸钠,滤液为碳酸钠溶液,加热时促进碳酸钠水解,但得到的氢氧化钠又与碳酸氢钠反应生成碳酸钠,最终得到的是碳酸钠,属于纯净物,故C不符合;
D.1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2,反应得到2mol硫酸钡沉淀和1mol偏铝酸钾,滤液为偏铝酸钾溶液,加热蒸干促进偏铝酸根水,但最终得到的KOH与氢氧化铝又反应得到偏铝酸钾,最终得到偏铝酸钾,为纯净物,故D不符合,
故选:A.
点评 本题考查元素化合物性质、化学方程式有关计算、盐类水解等,难度中等,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
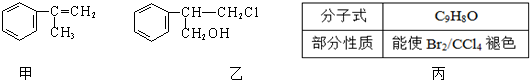
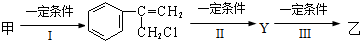
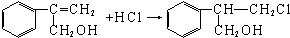 (不需注明反应条件).
(不需注明反应条件).
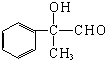 ;丙的结构简式为
;丙的结构简式为 .
. 、
、 、
、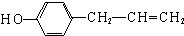 其中一种.
其中一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2<$\frac{{Q}_{1}}{2}$ | C. | Q2>$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶入100mL水中 | 配制4mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1~2mLFeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性强弱 |
| D | 用熔融氧化铝、CCl4做导电性实验 | 验证两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com