
| A、c(H+)=10-13mol/L的溶液中:NO3-、SO42-、K+、Na+ |
| B、澄清石灰水中:Na+、K+、CH3COO -、HCO3- |
| C、铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- |
| D、空气中:SO2、NO、N2、NH3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:


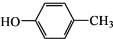 和CH3COOH为原料制备
和CH3COOH为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
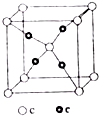 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| Mg |
| THF |
| BrR2 |
| Li,THF室温 |
| H3O+ |
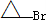 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有 的有机反应类型
的有机反应类型| NaOH水溶液 |
| △① |
| HBr |
| ② |
| Cu,O2,△ |
| ③ |
| 新制Cu(OH)2 |
| △④ |
| 酸化 |
| ⑤ |
| -HBr |
| ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、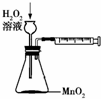 用以定量测定化学反应速率 |
B、 为用已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
C、 可以检查装置的气密性 |
D、 为实验室制取少量CO2的发生装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度 | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com