
 4NO + 6H2O ;2NO + O2= 2NO2
4NO + 6H2O ;2NO + O2= 2NO2 2N2 + 6H2O
2N2 + 6H2O 4NO + 6H2O。生成的NO极易被氧化生成红棕色的NO2,则该反应的化学方程式是2NO + O2= 2NO2。
4NO + 6H2O。生成的NO极易被氧化生成红棕色的NO2,则该反应的化学方程式是2NO + O2= 2NO2。 2N2 + 6H2O。
2N2 + 6H2O。

科目:高中化学 来源:不详 题型:单选题
| A.银的质量为10.8g |
| B.NO与NO2的体积比之比(相同条件下)为2:1 |
| C.原硝酸的物质的量浓度 (0.1mol+4b×10-3mol)/0.5L |
| D.沉淀中Cu(OH)2的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2和H2在点燃或光照条件下可合成氨气 |
| B.氨和HNO3都是电解质 |
| C.氨气遇到浓硝酸会发生反应产生大量白烟 |
| D.由NH3制HNO3的过程中,氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
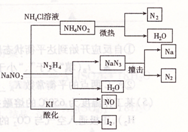
| A.NaNO2的稳定性大于NH4NO2 |
| B.NaNO2与N2 H4反应,NaNO2是氧化剂 |
| C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
| D.NaN3分解,每产生1molN2转移6mole- |
查看答案和解析>>
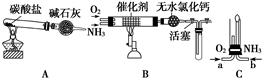
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HNO2非常不稳定,其分解产物为NO和H2O |
| B.NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解 |
| C.HNO2的酸性弱于碳酸的酸性 |
| D.NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀硝酸能与Fe发生反应,浓硝酸不能 |
| B.浓硝酸和稀硝酸都是强氧化剂 |
| C.稀硝酸是弱酸,浓硝酸是强酸 |
| D.稀硝酸与Cu反应生成NO,而浓硝酸与Cu反应生成NO2,稀硝酸得电子更多,故稀硝酸的氧化性大于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2KNO2+O2↑,
2KNO2+O2↑, 2CuO+4NO2↑+O2↑, 4AgNO3
2CuO+4NO2↑+O2↑, 4AgNO3 4Ag+4NO2↑+2O2↑
4Ag+4NO2↑+2O2↑ M(NO2)2+O2↑
M(NO2)2+O2↑  2MO+4NO2↑+O2↑
2MO+4NO2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com