
��12�֣���Ԫ�ؿ����γɶ����⻯���NH3��N2H4�ȡ�
��1���ݱ�����2016���й������䡰�칬���š��ռ�ʵ���ң������䡰����ʮһ�š����˷ɴ��͡�����һ�š����˷ɴ����롰�칬���š�����Խӡ����������Ҫ����ȼ�ϣ�ͨ������(N2H4)��ȼ�ϣ�N2O4������������֪
N2��g��+O2��g��=2NO��g����H=+180.7kJ?mol-1
2NO��g��+O2��g��=2NO2��g����H=-113.0kJ?mol-1
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ?mol-1
2NO2��g�� N2O4��g����H=-52.7kJ?mol-1
N2O4��g����H=-52.7kJ?mol-1
д����̬������̬������������ȼ�����ɰ�������̬ˮ���Ȼ�ѧ����ʽ��______________��
��2����ҵ����NH3��CO2Ϊԭ�Ϻϳ�����[CO(NH2)2]����Ӧ�Ļ�ѧ����ʽΪ2NH3��g��+CO2��g�� CO(NH2)2��l��+H2O��g�����÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ������ʾ��
CO(NH2)2��l��+H2O��g�����÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ������ʾ��
T/�� | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
�ٸ÷�Ӧ�ġ�H 0���>����<������
����֪ԭ�����еİ�̼�� Ϊx��CO2��ƽ��ת����Ϊa����һ���¶Ⱥ�ѹǿ�£�a��x�Ĺ�ϵ����ͼ��ʾ��a����x������������ԭ����__________��ͼ��A�㴦��NH3��ƽ��ת����Ϊ__________��
Ϊx��CO2��ƽ��ת����Ϊa����һ���¶Ⱥ�ѹǿ�£�a��x�Ĺ�ϵ����ͼ��ʾ��a����x������������ԭ����__________��ͼ��A�㴦��NH3��ƽ��ת����Ϊ__________��

��3��������ˮ��ˮϡ�͵Ĺ����У�NH3��H2O�ĵ���̶�____�����������С�����䡱����ͬ���� ��ֵ__________��
��ֵ__________��
�������£�amol/L��(NH4)2SO4��Һ��pH=5��ԭ����__________________�������ӷ���ʽ��ʾ�����÷�Ӧ��ƽ�ⳣ��Ϊ__________���ú�a����ѧ����ʽ��ʾ����
��1��2N2H4(g)+N2O4(g) 3N2(g)+4H2O(g) ��H=-1 083.0 kJ��mol-1��2�֣�
3N2(g)+4H2O(g) ��H=-1 083.0 kJ��mol-1��2�֣�
��2���٣���1�֣� ������c(NH3)��ƽ�������ƶ����Ӷ����CO2��ת���ʣ�1�֣�42%��2�֣�
��3��������1�֣� ���䣨1�֣� ��NH4++H2O NH3��H2O+H+��2�֣�
NH3��H2O+H+��2�֣�
 ��
�� ��2�֣�
��2�֣�
��������
�����������1���ɢ�N2��g��+O2��g��=2NO��g����H=+180.7kJ?mol-1
��2NO��g��+O2��g��=2NO2��g����H=-113.0kJ?mol-1
��N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-534.0kJ?mol-1
��2NO2��g�� N2O4��g����H=-52.7kJ?mol-1
N2O4��g����H=-52.7kJ?mol-1
���ݸ�˹���ɿ�֪?��2-��-?-?��2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����
��H=��-534.0kJ?mol-1����2-��-52.7kJ?mol-1��-��180.7kJ?mol-1��-��-113.0kJ?mol-1��=-1083.0 kJ?mol-1��
���Ȼ�ѧ����ʽΪ2N2H4��g��+N2O4��g��=3N2��g��+4H2O��g����H=-1083.0 kJ?mol-1����2���������¶����ߣ�Kֵ��С������Ӧ����Ϊ���ȣ���H<0���ڸ������ͼ�������������Ũ��ƽ��������У��Ӷ���߶�����̼��ת���ʣ�A�㴦x=3��ԭ�����е�NH3��CO2�����ʵ���֮��Ϊ3��������̼ת����Ϊ63%�����谱��Ϊ3mol��������̼Ϊ1mol����Ӧ�Ķ�����̼Ϊ0.63mol�����ݻ�ѧ����ʽ
2NH3��g��+CO2��g�� CO��NH2��2��l��+H2O��l����Ӧ�İ���Ϊ1.26mol��NH3��ƽ��ת����=1.26mol��3mol��100%=42% ����3�����ڰ�ˮ��ˮϡ�͵Ĺ����У���ˮ�ĵ���̶�������ƽ�ⳣ��Kֵֻ���¶��йأ����䣻�������£�amol/L��(NH4)2SO4��Һ��pH=5��ԭ����笠�������ˮ��������
CO��NH2��2��l��+H2O��l����Ӧ�İ���Ϊ1.26mol��NH3��ƽ��ת����=1.26mol��3mol��100%=42% ����3�����ڰ�ˮ��ˮϡ�͵Ĺ����У���ˮ�ĵ���̶�������ƽ�ⳣ��Kֵֻ���¶��йأ����䣻�������£�amol/L��(NH4)2SO4��Һ��pH=5��ԭ����笠�������ˮ��������
NH+H2O NH3��H2O+H+���÷�Ӧ��ƽ�ⳣ��ΪK=C(NH3��H2O)��C(H+)/C(NH4+)=
NH3��H2O+H+���÷�Ӧ��ƽ�ⳣ��ΪK=C(NH3��H2O)��C(H+)/C(NH4+)=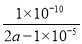
���㣺�����˹���ɡ��ȷ���ʽ����д����ѧƽ�ⳣ������ѧƽ���ͼ��ͼ��㣬������ʵĵ���������ˮ�⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
(8��)���и���Ӧ�У�ͨ������巴Ӧ�����ʲô���ã���ѡ�����������գ�
A��ֻ�������� B��ֻ����ԭ��
C������������������ԭ�� D���Ȳ����������ֲ�����ԭ��
��1������ͨ��ˮ�У�Cl2+H2O===HCl+HClO______________________
��2����������ͨ��ˮ�У�3NO2+H2O===2HNO3+NO__________________
��3��������̼����ͨ������������Һ�У�CO2+2KOH===K2CO3+H2O____________
��4��������������ͨ���������У�SO2+2H2S===3S�� +2H2O_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�����¶ȣ��������ݲ�һ���������
A����ѧ��Ӧ���� B��KNO3���ܽ��S
B��KNO3���ܽ��S
C����ѧƽ�ⳣ��K D��ˮ�����ӻ�����KW
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������CO2����ͨ���������Һ�У�Ȼ��������ɣ����ڸ����³�ַ�Ӧ��������õĹ���������
A��Na2SiO3 B��Na2CO3��Na2SiO3 C��Na2CO3��SiO2 D��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʷ����˵����������
A������I2��KMnO4���ֹ���ʱ����ѡ�����ʹI2�����ķ���
B����ȥAgI�����е�NaIʱ���ɽ���װ���ð�Ĥ���Ĵ������������������ˮ�У��÷��뷽����Ϊ����
C������ˮ�к���Ca2+��Mg2+��Fe3+��SO42�������ӣ�����ͨ����ѧ��������ȥ����:����ͨ������Ba(NO3)2�ķ�����ȥ���е�SO42��
D���Ӻ�������ȡ�ⵥ��ʱ�����Խ������պ��ˮ�ܽ���ˣ�����Һ�м�������ˮ����Ԫ������ΪI2��������Ҵ���ȡ�����ʵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��һ������ѧ�ڴ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
��������ʵ������������ܵó���Ӧ���۵���
ѡ�� | ʵ����� | ���� | ���� |
A | ������Һ��ͨ��CO2�� �ڼ���ͨ��CO2������ | ����Һ����� �ڻ��Dz���ʧ | ԭ��Һһ����NaAlO2��Һ |
B | ������Һ�м���KSCN��Һ���ڵ���һ�������� | ����Һ���������� ����Һ��ΪѪ��ɫ | ԭ��Һ�п��ܺ���Fe2+��NO3- |
C | �ýྻ��˿պȡ������Һ������ɫ��Ӧ | ����ʻ�ɫ | ԭ��Һһ����������Һ |
D | ����Һ�м������� | ����������ʹ����ʯ��ˮ����� | ԭ��Һ��һ������CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��һ������ѧ�ڴ�������ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�ӦI�ͷ�Ӧ������ͬһ�ַ�Ӧ���͵���
ѡ�� | ��Ӧ�� | ��Ӧ�� |
A | �����������ڹ�������������һ�ȼ��� | �����̼������Һ��Ӧ |
B | �Ҵ��ڴ���������������ȩ | ��ϩ��������Ȼ�̼��Һ��Ӧ |
C | ��֬�Ʊ����� | ��ϩ�Ʊ�����ϩ |
D | ����Һ�巴Ӧ�Ʊ��屽 | �Ҵ������ᷴӦ�Ʊ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ�����и�����ѧ��1�½�ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڿ��淴Ӧ2A(g)+3B(g) xC(g)+D(g)�У���֪����Ӧ��ʼ���������ֻ��A��B����ʼŨ��AΪ5 mol��L-1��BΪ3 mol��L-1��ǰ2 min C��ƽ����Ӧ����Ϊ0.5 mol��L-1��min-1��2 minĩ�����D��Ũ��Ϊ0.5 mol��L-1������ڴ˷�Ӧ������˵������ȷ����
xC(g)+D(g)�У���֪����Ӧ��ʼ���������ֻ��A��B����ʼŨ��AΪ5 mol��L-1��BΪ3 mol��L-1��ǰ2 min C��ƽ����Ӧ����Ϊ0.5 mol��L-1��min-1��2 minĩ�����D��Ũ��Ϊ0.5 mol��L-1������ڴ˷�Ӧ������˵������ȷ����
A��2 minĩʱA��B��Ũ��֮��Ϊ5��3
B��x=1
C��2 minĩʱB��Ũ��Ϊ1.5 mol��L-1
D��ǰ2 min��A������Ũ��Ϊ0.5 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���к�����������ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���б仯�����������������ʵ�ֵ���
A��Cr2O72-��CrO42- B��HNO3 ��NO2
C��SiO2 ��Si D��CH3CH2OH��CH3CHO
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com