
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):过量Ba(NO3)2溶液,过滤 | ||
| C. | CO2(HCl):饱和NaHCO3溶液、洗气 | D. | CaCO3(CaO):水、过滤 |
分析 A.二者均与硝酸银反应;
B.硫酸钾与硝酸钡反应生成硫酸钡,但试剂过量引入新杂质;
C.HCl与饱和碳酸氢钠反应生成二氧化碳;
D.CaO与水反应,氢氧化钙不溶于水.
解答 解:A.二者均与硝酸银反应,不能除杂,故A错误;
B.硫酸钾与硝酸钡反应生成硫酸钡,但试剂过量引入新杂质,应加适量的试剂,故B错误;
C.HCl与饱和碳酸氢钠反应生成二氧化碳,则饱和NaHCO3溶液、洗气可除杂,故C正确;
D.CaO与水反应,氢氧化钙不溶于水,则加水、过滤可除杂,故D正确;
故选CD.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
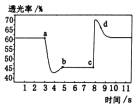 已知反应:2NO2(红棕色)?N2O4(无色)△H<O.将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(红棕色)?N2O4(无色)△H<O.将一定量的NO2充入注射器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小).下列说法不正确的是( )| A. | b点达到平衡状态 | |
| B. | b点与a点相比,c(NO2)、c(N2O4)均减小 | |
| C. | d点:v(正)<v(逆) | |
| D. | 若在c点将温度降低,其透光率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g•cm-1 | 溶解性 |
| 乙二醇 | C2H4O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
| A. | 分液 | B. | 蒸馏 | C. | 冷却至0℃后过滤 | D. | 加水萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:4 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al$→_{△}^{O_{2}}$Al2O3 $\stackrel{HNO_{3}}{→}$Al(NO3)3$→_{△}^{蒸干、灼烧}$Al2O3 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{蒸发、结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{灼烧}{→}$Fe2O3 | |
| D. | FeSO4溶液$\stackrel{H_{2}S}{→}$FeS$\stackrel{过滤蒸干}{→}$FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | α1=α2<α3=α4 | B. | α1=α3<α2=α4 | C. | α1>α2>α3>α4 | D. | α1=α4>α2=α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 向CuCl2溶液中加入CuO,调节溶液的pH可除去溶液中混有的Fe3+ | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
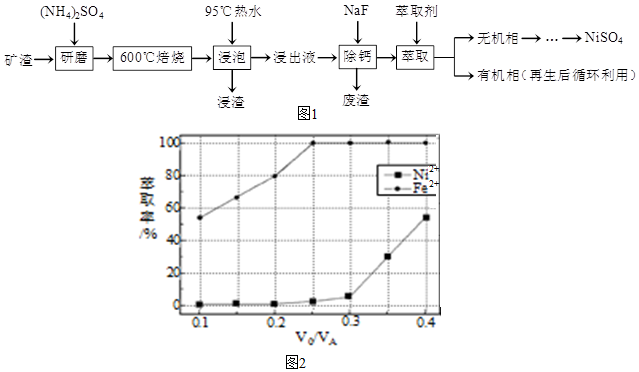
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com