
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 镁必须密封保存在容器中,防止镁跟空气中的氧气反应 |
分析 A.稀释浓硫酸,应将浓硫酸加到水中;
B.镁离子与碱反应生成氢氧化镁沉淀;
C.过滤操作应用玻璃棒引流;
D.Mg被氧化后,表面氧化膜可保护内部Mg.
解答 解:A.稀释浓硫酸,应将浓硫酸加到水中,而不能将水加入浓硫酸中得到稀硫酸,故A错误;
B.将NaOH溶液缓慢滴入MgSO4溶液中,镁离子与碱反应生成氢氧化镁沉淀,故B正确;
C.过滤操作应利用玻璃棒引流,将浊液倒入已装好滤纸的漏斗中过滤,故C错误;
D.Mg被氧化后,表面氧化膜可保护内部Mg,则镁不需要密封保存在容器中,故D错误;
故选B.
点评 本题考查实验方案的评价,为高频考点,涉及稀释、过滤等实验操作及离子的反应等知识,把握物质的性质、实验基本操作等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4、稀H2SO4都难挥发 | |
| B. | 浓H2SO4、稀H2SO4都有氧化性,故浓H2SO4、稀H2SO4都是氧化性的酸 | |
| C. | 浓H2SO4、稀H2SO4在加热时都能与铜反应 | |
| D. | 浓H2SO4、稀H2SO4在常温下都能用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ①⑥ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
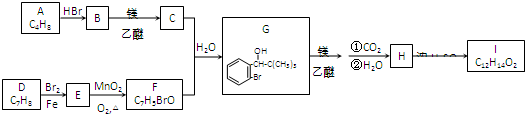
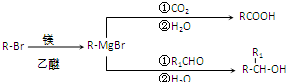
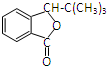 .
. .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的稳定性介于Na2CO3•10H2O和NaHCO3之间 | |
| B. | “侯氏制碱法”制得的碱是指NaHCO3 | |
| C. | 可用盐酸鉴别Na2CO3 和NaHCO3固体 | |
| D. | 纯碱有时可代替烧碱使用,比如溶解石英、吸收氯气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解 | |
| B. | Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al | |
| D. | 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,FeS2中的硫元素全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

 的名称是3-甲基-1-丁醇
的名称是3-甲基-1-丁醇| A. | ①③④ | B. | ①⑤⑥ | C. | ③④ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
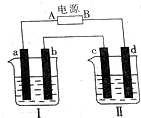 如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:
如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的氧化物对应的水化物可能具有两性 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com