
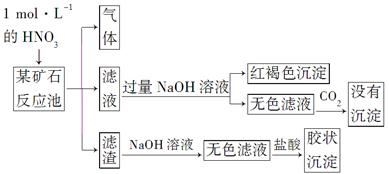
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是___________________________________。
(2)下列说法正确的是________。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是________,滤渣和NaOH溶液反应的离子方程式是_________________________________________________________。
(4)该矿石和1 mol·L-1HNO3反应的离子方程式为
___________________________________________________________。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中。目的是____________________________________;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol·L-1 HNO3的体积为________L。
(1)第三周期第ⅣA族
(2)abc
(3)FeCO3和SiO2 SiO2+2OH-=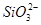 +H2O
+H2O
(4)3FeCO3+10H++ =3Fe3++3CO2↑+NO↑+5H2O
=3Fe3++3CO2↑+NO↑+5H2O
(5)NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸提高原料利用率 3.3×104
【解析】(3)与硝酸反应生成气体及与NaOH溶液反应生成红褐色沉淀,可知一定含有FeCO3,通入CO2反应无沉淀生成,可知矿石中无Al2O3;滤渣与NaOH反应后加入盐酸有胶状沉淀产生可知矿渣中含有SiO2。
(5)m(FeCO3)=2.36×106g-1.2×106 g=1.16×106g,n(FeCO3)=1×104 mol,依据方程式3FeCO3+10HNO3=3Fe(NO3)3+3CO2↑+NO↑+5H2O可知n(HNO3)=3.3×104 mol。


科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2.2 pH的计算试卷(解析版) 题型:填空题
有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测:
(1)该学生的操作是 (填“正确的”或“错误的”),其理由是 。
(2)若用此方法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
(3)该学生以上述方式测定下列溶液的pH,无误差的是( )
A.NaOHB.CH3COONa C.NaClD.NaHSO4
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:选择题
在2NO2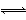 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A.N2O4和NO2的分子数比为1∶2
B.N2O4和NO2的浓度相等
C.平衡体系的颜色不再改变
D.单位时间内有1 mol N2O4变为NO2的同时,有2 mol NO2生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学镁、铝及其化合物主要性质(解析版) 题型:选择题
下列实验与对应示意图的关系正确的是
A | B | C | D |
NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铜及其化合物主要性质、合金(解析版) 题型:选择题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。
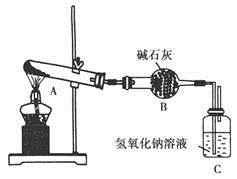
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学铁及其化合物主要性质(解析版) 题型:选择题
34 g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。下列说法中正确的是
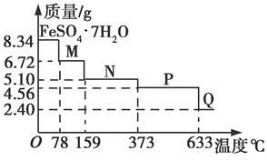
A.温度为78℃时固体物质M的化学式为FeSO4·5H2O
B.温度为159℃时固体物质N的化学式为FeSO4·3H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
A.标准状况下,反应过程中得到7.84 L的气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g的沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学速率表示与平衡移动(解析版) 题型:选择题
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
①用物质 A 表示的反应的平均速率为 0.3 mol·L-1·S-1
②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·S-1
③2 s 时物质 A 的转化率为70%
④2 s 时物质 B 的浓度为 0.7 mol·L-1,
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co,工艺流程简图如下: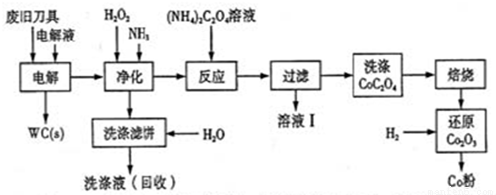
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液,阴极主要的电极反应为 ;
(2)净化步骤所得滤饼的主要成分是Fe(OH)3,回收的洗涤液代替水配制电解液,目的是回收利用其中的 ;
(3)溶液I的主要成分是NH4Cl,洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 ;
(4)将Co2O3还原成Co粉的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com