
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:不详 题型:填空题
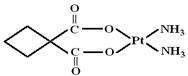
| A.极性共价键 | B.非极性共价键 | C.配位键 | D.离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.I—Cl键为极性共价键 |
| B.ICl分子为共价化合物分子 |
| C.该物质在反应中通常体现氧化性 |
| D.在反应ICl+2NaOH====NaCl+NaIO+H2O中作氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
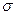 键与
键与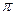 键的数目之比为
键的数目之比为
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.离子键 | B.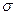  键 键 | C.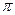 键 键 | D.氢键 E.配位键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C60气化和金刚石熔化克服的作用力相同 |
| B.甲酸甲酯的熔点低于乙酸的熔点 |
| C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 |
| D.分子晶体的熔沸点低,常温下均呈液态或气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com