
| A、常温下,在pH=8的HCOONa溶液中:c(Na+)-c(HCOO-)=9.9×10-7mol/L |
| B、Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-) |
| C、室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3?H2O; c(NH4+)由大到小的顺序是:②>①>③>④ |


科目:高中化学 来源: 题型:
| A、②③④⑤⑥⑦ | B、③④⑦ |
| C、②③④⑦ | D、①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
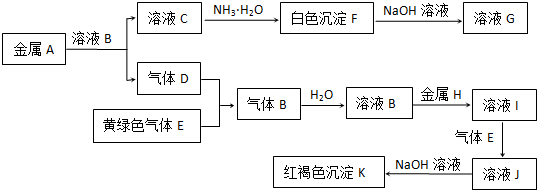
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有机物一定都含碳、氢元素 |
| B、分子中含有羟基的化合物属于醇类 |
| C、分子式相同,各元素质量分数也相同的物质是同种物质 |
| D、有机物分子中,氢原子数不一定都是偶数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1 NaHCO3溶液中:c(CO3 2- )>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H2CO3)+c(H+ ) |
| C、某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子,该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| D、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2 Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2 Fe(SO4)2]<c[(NH4)2 SO4]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
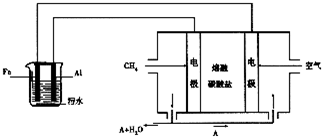 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清透明溶液中:Cl-、NO3-、Cu2+、NH4+ |
| B、水电离产生的c(OH-)=1×10-11mol/L的溶液:Cu2+、SO42-、NO3-、Cl- |
| C、中性溶液中:Fe3+、Al3+、NO3-、SO42- |
| D、能使苯酚变紫色的溶液:K+、Mg2+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| A、该反应是置换反应 |
| B、该反应是复分解反应 |
| C、碳元素化合价降低 |
| D、该反应是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com