
实验室用50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 起始温度t1/℃ 终止温度t2/℃
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23 .8
.8
3 21.5 21.6 24.9
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 .
(2)在操作正确的前提下,提高中和热测定准确性的关键是: .
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H= .如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、“不变”).
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温 较高
较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
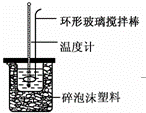
考点: 中和热的测定.
专题: 实验设计题.
分析: (1)金属导热快,热量损失多;
(2)中和热测定实验成败的关键是保温工作;
(3)先求出三次反应的温度差,根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出反应热,氢氧化钠固体溶于水放热;
(4)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断;
解答: 解:(1)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,故答案为:Cu传热快,热量损失大;
(2)中和热测定实验主要目的是测量反应放出的热量多少,所以实验成败的关键是保温工作,所以提高中和热测定准确性的关键是提高装置的保温效果,故答案为:提高装置的保温效果;
(3)(2)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:3.45℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应前后温度差为:3.40℃;
第3次实验盐酸和NaOH溶液起始平均温度为21.55℃,反应前后温度差为:3.35℃;
50mL 0.50mol•L﹣1盐酸、50mL 0.55mol•L﹣1 NaOH的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g× =1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为
=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为 =56.8kJ,即该实验测得的中和热△H=﹣56.8kJ/mol;氢氧化钠固体溶于水放热,所以实验中测得的“中和热”数值将偏大
=56.8kJ,即该实验测得的中和热△H=﹣56.8kJ/mol;氢氧化钠固体溶于水放热,所以实验中测得的“中和热”数值将偏大
故答案为:﹣56.8 kJ/mol;偏大;
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,碱的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,会使得中和和热的测定数据偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故F正确.
故ABDF正确.
故答案为:ABDF.
点评: 本题考查中和热的测定,题目难度不大,注意热量计算公式的应用中c=4.18J/(g•℃),要注意热量单位的换算.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
下列说法正确的是()
A. 需要加热方能发生的反应一定是吸热反应
B. 若反应为放热反应,则该反应不必加热就可发生
C. 放热反应比吸热反应容易发生
D. 化学反应总是伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应mA(g)+nB(g)⇌pC(g),达到平时,测得c(A)为0.5mol•L﹣1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3mol•L﹣1.则下列判断正确的是()
A. 化学计量数:m+n>p B. 平衡向正反应方向移动了
C. 物质B的转化率减小了 D. 物质C的质量分数增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B⇌3C+4D反应中,表示该反应速率最快的是()
A. υ(A)=0.5 mol/(L•s) B. υ(B)=1 mol/(L•s)
C. υ(C)=0.8 mol/(L•s) D. υ(D)=0.3 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 正反应是放热反应.若反应物起始的物质的量相等,下列关于该反应的示意图不正确的是()
A. 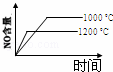 B.
B. 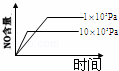 C.
C. 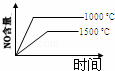 D.
D. 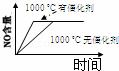
查看答案和解析>>
科目:高中化学 来源: 题型:
我们饮用的水是由源水净化所得。已知,明矾能将水中的悬浮物凝聚而沉淀,氯气可杀菌。家庭饮用水的净化过程正确的是 ( )。
A.源水→过滤→加氯气→加明矾→沉淀→净水
B.源水→加氯气→过滤→加明矾→沉淀→净水
C.源水→加明矾→加氯气→过滤→沉淀→净水
D.源水→加明矾→沉淀→过滤→加氯气→净水
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为分别得到各含一种金属阳离子的沉淀物。可采取①通入H2S气体,②通入CO2气体,③加入盐酸,④加入氢氧化钠溶液四个步骤,每次通入或加入试剂均过量,且每次都把沉淀物滤出,其操作的正确顺序是 ( )。
A.③①④② B.①③④②
C.④②①③ D.④②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是()
A. 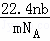 L B.
L B.  C.
C. 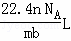 D.
D. 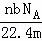 L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的数值,下列说法正确的是()
A. 标准状况下,22.4LCCl4含有NA个分子
标准状况下,22.4LCCl4含有NA个分子
B. 0.1molAlCl3完全转化为胶体,生成胶体粒子的数目为0.l NA个
C. 常温常压下46gNO2和N2O4的混合气体含有3NA个原子
D. 0.1molCl2与足量冷的NaOH溶液反应,转移电子数为0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com