
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:

请你帮助该同学整理并完成实验报告:
(1)实验目的:_______________。
(2)实验用品:
仪器:________________;药品:__________。
(3)实验内容:(填写题给信息表中的序号)_____
实验方案 | 实验现象 | 有关化学方程式 |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
_____ | _____ | _____ |
(4)实验结论:____________。
(5)请用物质结构理论简单说明具有上述结论的原因。__________
(6)请你补充两组简单易行的实验方案,证明此周期中另外两种元素的性质递变规律。_________
【答案】验证第三周期元素从左到右金属性递减、非金属性递增的规律 试管、酒精灯、砂纸、镊子、小刀、胶头滴管等 镁带、钠、铝条、新制氯水、新制硫化氢饱和溶液、2 mol·L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液 ③ A 2Na+2H2O=2NaOH+H2↑ ① B Mg+2H2O![]() Mg(OH)2+H2↑ ④ D Mg+2HCl=MgCl2+H2↑ ⑤ C 2Al+6HCl=2AlCl3+3H2↑ ⑥ E AlCl3+NaOH=Al(OH)3↓+3NaCl、Al(OH)3+ NaOH=NaAlO2+2H2O ② F H2S+Cl2=2HCl+S↓ 金属性:Na>Mg>Al 非金属性:Cl>S Na、Mg、Al、S、Cl原子核外都有三个电子层,但最外层电子数依次为1、2、3、6、7,原子半径随核电荷数增多而减小,所以原子核对最外层电子的吸引力依次增强,原子失电子能力减弱,得电子能力增强。 方案一:测定0.1 mol·L-1的Na2SiO3溶液、Na3PO4溶液的pH,由此判断两种盐溶液的水解能力,得出硅酸、磷酸两种最高价含氧酸的酸性强弱顺序,进而得出硅、磷两种元素非金属性强弱的顺序。
Mg(OH)2+H2↑ ④ D Mg+2HCl=MgCl2+H2↑ ⑤ C 2Al+6HCl=2AlCl3+3H2↑ ⑥ E AlCl3+NaOH=Al(OH)3↓+3NaCl、Al(OH)3+ NaOH=NaAlO2+2H2O ② F H2S+Cl2=2HCl+S↓ 金属性:Na>Mg>Al 非金属性:Cl>S Na、Mg、Al、S、Cl原子核外都有三个电子层,但最外层电子数依次为1、2、3、6、7,原子半径随核电荷数增多而减小,所以原子核对最外层电子的吸引力依次增强,原子失电子能力减弱,得电子能力增强。 方案一:测定0.1 mol·L-1的Na2SiO3溶液、Na3PO4溶液的pH,由此判断两种盐溶液的水解能力,得出硅酸、磷酸两种最高价含氧酸的酸性强弱顺序,进而得出硅、磷两种元素非金属性强弱的顺序。
方案二:在硅酸钠溶液中滴加磷酸溶液,可发生反应生成硅酸沉淀。
【解析】
根据元素周期律的相关知识进行分析解答。根据实验金属和水、酸反应的现象推断金属的活泼性,根据非金属间的置换反应判断非金属性的强弱。
(1)①③④⑤可比较金属性强弱,②可比较非金属性强弱。所以实验目的为验证第三周期元素从左到右金属性递减、非金属性递增的规律或探究第三周期元素性质递变规律。故答案为:第三周期元素从左到右金属性递减、非金属性递增的规律或探究第三周期元素性质递变规律;
(2)根据实验方案可知需要的仪器有:试管、酒精灯、砂纸、镊子、小刀、胶头滴管
需要的药品有:镁带、钠、铝条、新制氯水、新制硫化氢饱和溶液、2 mol·L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液。故答案为:试管、酒精灯、砂纸、镊子、小刀、胶头滴管等;镁带、钠、铝条、新制氯水、新制硫化氢饱和溶液、2 mol·L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液。
(3)根据实验方案填写题给信息如表中:
实验方案 | 实验现象 | 有关化学方程式 |
① | B | Mg+2H2O |
② | F | H2S+Cl2=2HCl+S↓ |
③ | A | 2Na+2H2O=2NaOH+H2↑ |
④ | D | Mg+2HCl=MgCl2+H2↑ |
⑤ | C | 2Al+6HCl=2AlCl3+3H2↑ |
⑥ | E | AlCl3+NaOH=Al(OH)3↓+3NaCl、 Al(OH)3+ NaOH=NaAlO2+2H2O |
(4)①金属越活泼,与水反应越剧烈,由实验现象能证明钠比镁金属性强的实验方案是①③,金属越活泼,与酸反应越剧烈,由实验现象能证明镁比铝金属性强的实验方案是④⑤,所以金属性:Na>Mg>Al。由实验②H2S+Cl2=2HCl+S↓反应可知,非金属性:Cl>S;
故答案为:金属性Na>Mg>Al;非金属性:Cl>S 。
(5)因为Na、Mg、Al、S、Cl原子核外都有三个电子层,但最外层电子数依次为1、2、3、6、7,原子半径随核电荷数增多而减小,所以原子核对最外层电子的吸引力依次增强,原子失电子能力减弱,得电子能力增强,所以金属性逐渐减弱,非金属逐渐增强。答案: Na、Mg、Al、S、Cl原子核外都有三个电子层,但最外层电子数依次为1、2、3、6、7,原子半径随核电荷数增多而减小,所以原子核对最外层电子的吸引力依次增强,原子失电子能力减弱,得电子能力增强。
(6)方案一:测定0.1 mol·L-1的Na2SiO3溶液、Na3PO4溶液的pH,由此判断两种盐溶液的水解能力,得出硅酸、磷酸两种最高价含氧酸的酸性强弱顺序,进而得出硅的非金属性比磷元素的非金属性弱。
方案二:在硅酸钠溶液中滴加磷酸溶液,可发生反应生成硅酸沉淀,由此可知酸性:H2SiO3< H3PO4,进而得出硅的非金属性比磷元素的非金属性弱。答案:方案一:测定0.1 mol·L-1的Na2SiO3溶液、Na3PO4溶液的pH,可知pH(Na2SiO3)> pH(Na3PO4),由此判断两种盐溶液的水解能力,酸性:硅酸<磷酸,两种最高价含氧酸的酸性强弱顺序,进而得出硅、磷两种元素非金属性强弱的顺序。方案二:在硅酸钠溶液中滴加磷酸溶液,可发生反应生成硅酸沉淀。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将 | 先无现象后产生白色胶状沉淀 |
|
B | 向2支盛有醋酸和硼酸溶液的管中分别滴加 | 醋酸:产生气泡; 硼酸:无现象 |
|
C | 将少量 | 沉淀由红褐色变为白色 |
|
D | 溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 溴乙烷发生消去反应生成了乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋![]() 主要成分是
主要成分是![]() 的总酸量
的总酸量![]() 。已知
。已知![]() 终点时所得溶液呈碱性。
终点时所得溶液呈碱性。
Ⅰ、实验步骤:
(1)用移液管量取![]() 食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液![]() 于锥形瓶中。
于锥形瓶中。
(3)滴加2滴_____________作指示剂。
(4)读取盛装![]() 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。
溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为 ________mL。

(5)滴定,当______________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。Ⅱ![]() 实验记录
实验记录

Ⅲ、数据处理与讨论:
(1)根据上述数据分析得![]() 市售白醋
市售白醋![]() ________
________![]() 。
。
(2)在本实验的滴定过程中,下列操作会使实验结果偏小的是_______![]() 填写序号
填写序号![]() 。
。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
E. 滴定终点读数时俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗氧气的质量不变的是
A. CH4O,C3H4O5B. C3H6,C3H8O
C. C3H8,C4H6D. C2H6,C4H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
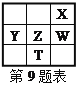
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵![]() 加入密闭容器中,发生反应
加入密闭容器中,发生反应![]() 。该反应的平衡常数的负对数
。该反应的平衡常数的负对数![]() K
K![]() 值随温度
值随温度![]() T
T![]() 的变化曲线如图所示,下列说法错误的是
的变化曲线如图所示,下列说法错误的是
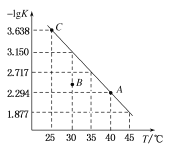
A.C点对应状态的平衡常数 K( C )![]()
B.该反应的![]() H
H ![]()
C.![]() 的体积分数不变时,该反应一定达到平衡状态
的体积分数不变时,该反应一定达到平衡状态
D.30℃时, B点对应状态的 v![]() 正
正![]() v
v![]() 逆
逆![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容器中进行,下列条件的改变对其速率几乎无影响的是
CO(g)+H2(g)在一可变容器中进行,下列条件的改变对其速率几乎无影响的是
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充水蒸汽使体系压强增大
D.保持压强不变,充氮气使容器体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2M(g)![]() N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )

A.a、b、c、d四个点中处于平衡状态的点是a、b、d
B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN
C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度
D.若40min后出现如图所示变化,则可能是加入了某种催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途见下图。

下列说法不正确的是
A.NaNO2的稳定性大于NH4NO2
B.NaNO2与N2H4反应,NaNO2是氧化剂
C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2
D.NaN3分解,每产生1 molN2转移6 mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com