
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | NaNO3溶液 | Na2SO4 | 加入过量BaCl2溶液,过滤 |
| B | 水 | 油 | 过滤 |
| C | CO2 | HCl | 通过盛有NaOH溶液的洗气瓶 |
| D | 乙醇(C2H5OH) | H2O | 加入生石灰CaO,蒸馏 |
| A、A | B、B | C、C | D、D |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaOH溶液:K+、Ba2+、Cl-、HCO3- |
| B、0.1 mol?L-1 Na2CO3溶液:K+、NH4+、NO3-、SO42- |
| C、0.1 mol?L-1 FeCl3溶液:K+、Na+、I-、SCN- |
| D、0.1 mol?L-1 HCl的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质焰色反应呈黄色,结论:该物质是钠盐 |
| B、无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3 |
| C、无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42- |
| D、无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
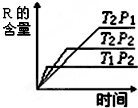 在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )| A、T2>T1,正反应放热,L是液体 |
| B、P2<P1,正反应吸热,L是固体 |
| C、T2<T1,正反应放热,L是气体 |
| D、P2>P1,正反应吸热,L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对煤进行脱硫、液化、气化加工,提高煤的综合利用率 |
| B、研究以植树秸秆为原料制取生物柴油 |
| C、为加快融雪,在高速路面上大范围使用融雪剂 |
| D、进行以“设计绿色化工工艺,提高原子利用率”为目标的技术革新 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.84g |
| B、1.06g |
| C、1.43g |
| D、2.27g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图1为实验室制取氨的实验装置.
如图1为实验室制取氨的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,增加反应物的量,必加快反应速率 |
| B、升高温度对放热反应会减慢反应速率,而对吸热反应才会加快反应速率 |
| C、增大压强,对所有反应都会加快反应速率 |
| D、使用催化剂会加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com