


科目:高中化学 来源:不详 题型:填空题
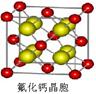
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NF3分子呈三角锥形 |
| B.NF3分子是极性分子 |
| C.NF3与NH3晶体类型相同 |
| D.上述反应中,反应物和生成物均属于共价分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
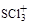 、SO2、SO32-、SO42-等。
、SO2、SO32-、SO42-等。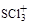 中S原子的轨道杂化类型是 ,
中S原子的轨道杂化类型是 ,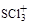 的空间构型是 。
的空间构型是 。| A.共价键 | B.氢键 | C.离子键 | D.配位键 E.分子间作用力 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
 (含B、O、H三种元素)的球棍模型如图所示:
(含B、O、H三种元素)的球棍模型如图所示:
 中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
中,硼原子轨道的杂化类型有 和________;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。 、
、 和
和 构成,它们之间存在的作用力有 (填序号)。
构成,它们之间存在的作用力有 (填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Cr(H2O)6] Cl3 | B.[Cr(H2O)3Cl3]·3H2O |
| C.[Cr(H2O)4Cl2] Cl·2H2O | D.[Cr(H2O)5 Cl] Cl2·H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C与A | B.C与D |
| C.D与B | D.B与C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com