
由下列5种基团中的2个不同基团两两组合,形成的有机物能与NaHCO3溶液反应的有( )
①—OH ②—CH3 ③—COOH ④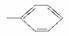 ⑤—CHO
⑤—CHO
A.2种 B.3种 C.4种 D.5种
科目:高中化学 来源: 题型:
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700 ℃脱氨得到无水氯化镁,脱氨反应的化学方程式为____________________;
电解熔融氯化镁,阴极的电极反应式为_______________________。
(2)储氢材料Mg(AlH4)2在110~200 ℃的反应为Mg(AlH4)2===MgH2+2Al+3H2↑,每生成27 g Al转移电子的物质的量为____________。
(3)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如下图。
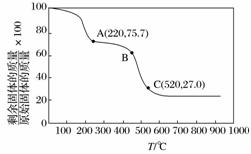
图中隔绝空气条件下B→C发生反应的化学方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 制得。实验室模拟该工业过程的装置如图所示。回答下列问题:

(1)b中反应的离子方程式为__________________________________,
c中试剂为____________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________。
(3)d中的试剂为______________。
(4)实验中要控制SO2生成速率,可以采取的措施有
________________________________________________________________________
___________________________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)A、C的化学式分别为A__________,C__________。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是________(填字母)。
A.C+2H2SO4(浓)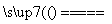 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4===FeSO4+H2↑
C.Cu+2H2SO4(浓)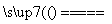 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2—→F的化学方程式:_______________________________________。
(4)若反应F+D—→E转移电子数为6.02×1023,则消耗D的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。
(2)M原子的外围电子排布式为_____。
(3) X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为___(任写一种)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对这三种晶体进行实验,结果如表:
| 序号 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
| A | 811 | 较大 | 易溶 | 水溶液或熔融导电 | 白色沉淀 |
| B | 3 500 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为A______________、B________________、C____________。
(2)晶体的类型分别是A______________、B_________________、C____________。
(3)晶体中微粒间作用力分别是A________、B__________________、C________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有5种单核粒子,它们分别是 □、
□、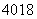 □、
□、 □+、
□+、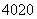 □2+、
□2+、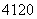 □(“□”内元素符号未写出),则它们所属元素的种类有______种。
□(“□”内元素符号未写出),则它们所属元素的种类有______种。
(2)1H、2H、3H三种微粒都属于________,因为它们是具有相同______________的同一类原子。
(3)在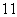 H、
H、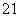 H、
H、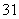 H、
H、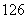 C、
C、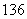 C、
C、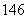 C、
C、 N、
N、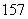 N中,核素、元素的种数分别为______种、______种。
N中,核素、元素的种数分别为______种、______种。
(4)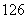 C、
C、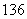 C、
C、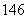 C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com