

分析 (1)原电池能够实现化学能转化为电能,根据构成原电池的条件:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应分析;
(2)能设计呈原电池的反应必须为氧化还原反应.
解答 解:(1)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,
A.无水乙醇为非电解质,该装置不能自发的进行氧化还原反应,所以不能形成原电池,故A错误;
B.该装置中电极材料相同,所以不能形成原电池,故B错误;
C.该装置符合构成原电池的条件,故C正确;
D.该装置不能构成闭合回路,所以不能形成原电池,故D错误;
C装置中Ag作正极,正极上氢离子得电子生成氢气,其电极反应为:2H++2e-=H2↑,负极为锌失电子生成锌离子,反应式为Zn-2e-=Zn2+;总反应为:2H++Zn=Zn2++H2↑;阴离子移向负极锌;装置中转移了0.2mol电子,根据总反应为:2H++Zn=Zn2++H2↑,则理论上整体质量增重0.1×65-0.1×2=6.3g.
故答案为:C;2H++Zn=Zn2++H2↑;Zn-2e-=Zn2+;2H++2e-=H2↑;Zn;6.3g;
(2)自发进行的放热的氧化还原反应能设计成原电池,NaOH+HCl=NaCl+H2O反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池,
故答案为:否;没有电子转移,不属于氧化还原反应.
点评 本题考查了原电池原理的应用、化学方程式的书写等,为高频考点,注意把握原电池的正负极的判断及电极反应方程式的书写方法是解决本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
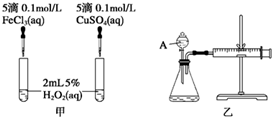
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请按要求回答下列问题:
请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
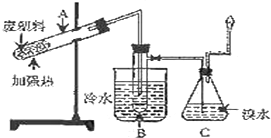 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
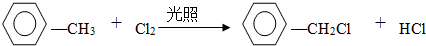 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
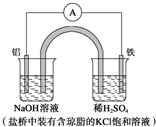
| A. | Fe作正极,发生氧化反应 | |
| B. | 负极反应:Al-3e-+3OH-═Al(OH)3↓ | |
| C. | 工作一段时间后,盛有稀硫酸溶液的杯中pH不变 | |
| D. | 盐桥中的Cl-向左边烧杯中移动,使该烧杯中溶液保持电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com