
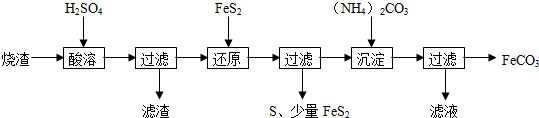
分析 烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中含有硫酸铵、碳酸铵.
(1)为了加快固体溶解,通常可以通过固体粉碎、搅拌及升温等措施;
(2)①Fe3+被FeS2还原,FeS2被氧化,氧化产物可能为S或SO42-,据此结合电子守恒、电荷守恒及原子守恒书写另外一个离子方程式;
②检验Fe3+常用KSCN溶液,看溶液是否呈血红色;
(3)①碳酸铵是不稳定的盐,受热易分解;
②碳酸亚铁表面会附着硫酸铵,检验最后一次洗涤液中是否含有硫酸根离子判断洗涤是否干净;“沉淀”时,pH过高时溶液中的亚铁离子会转化氢氧化亚铁沉淀,进而生成氢氧化铁;
(4)根据实验现象来分析解答;
(5)在空气中煅烧FeCO3,生成氧化铁和二氧化碳.
解答 解:烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中含有硫酸铵、碳酸铵;
(1)可以通过加热、增加硫酸的浓度、固体粉碎及搅拌等措施提高酸浸时反应速率,故答案为:加热、增加硫酸的浓度、将烧渣粉碎、搅拌等;
(2)①Fe3+被FeS2还原成Fe2+,发生反应的离子方程式包括:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+、FeS2+2Fe3++=3Fe2++2S↓,故答案为:FeS2+2Fe3++=3Fe2++2S↓;
②Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全可选择KSCN溶液,具体方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反应,未反应完全;故答案为:取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反应,未反应完全;
(3)①温度过高,碳酸铵易分解,沉淀不完全,
故答案为:防止碳酸铵分解,减小亚铁离子的水解程度;
②碳酸亚铁表面会附着硫酸铵,所以检验FeCO3是否洗净,可以检验洗涤滤液中是否有硫酸根离子,具体方法为:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净,
故答案为:取少许最后一次洗涤液于试管中,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,反之,则说明没洗涤干净;
(4)红褐色固体是Fe(OH)3,FeCO3、H2O和O2反应生成Fe(OH)3和CO2,故答案为:O2、H2O;
(5)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,设Fe2O3的质量为x,根据化学反应前后铁元素质量不变可得:$\frac{112}{160}$×100%×x+$\frac{56}{72}$×100%×(15.84 kg-x)=$\frac{56}{116}$×100%×23.2 kg,解答x=14.4 kg,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;14.4.
点评 本题属于信息题的考查,考查了铁及其化合物的性质,主要通过发生流程知道反应物和生成物进行相关问题的分析,涉及实验的基本操作、离子的检验及化学计算,能够考查学生的知识分析能力,属基础考查,难度不大.


 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:实验题
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

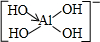 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com