
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| C、1 L一氧化碳气体一定比1 L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若物质的量相等则体积相等,但质量不相等 |


科目:高中化学 来源: 题型:
| A、福尔马林可作食品的保鲜剂 |
| B、氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 |
| C、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 |
| D、浓硫酸可刻蚀石英制艺术品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径大小关系是Xn-<Yn+ |
| B、Z一定是稀有气体元素的原子 |
| C、原子序数关系是Z>Y>X |
| D、原子半径关系是Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:
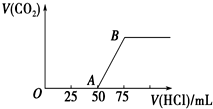 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、1.5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥⑧ |
| B、②③⑤⑦⑧ |
| C、②③⑤⑥⑦ |
| D、②③④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com