
����Ŀ����������к���Cr��OH��3��Al2O3��ZnO��CuO��NiO�����ʣ���ҵ��ͨ���������̻���Na2Cr2O7��������
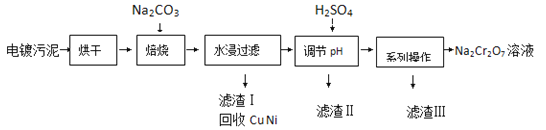
��֪��
��Cr��OH��3��ZnO��Al2O3һ����Ϊ���Ի�������
��Na2Cr2O7��Na2SO4�ڲ�ͬ�¶��µ��ܽ�����±���
20�� | 60�� | 100�� | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
��1�����չ���������Na2CrO4�Ļ�ѧ����ʽΪ ��ˮ������Һ�г�Na2CrO4�����ڵ������� �� ��
��2������H2SO4����pH��Ŀ��Ϊ ��
��3���õ��������ġ�ϵ�в������IJ���Ϊ �� ���ˣ�
��4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g��CrO42����8/9ת��ΪCr2O72������ת����������Һ��c��Cr2O72���� = molL��1��
��5����Na2Cr2O7��H2SO4���Һ�м���H2O2���ټ������Ѳ�ҡ�������Ѳ�Ϊ��ɫ������������CrO5��������Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡���1��4Cr��OH��3+4Na2CO3+3O2![]() 4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2��
4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2��
��2����ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72����
��3������Ũ������ȴ�ᾧ����4��0.2��
��5��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��
��������
�����������1����ʵ��������Na2CrO4�����ݵ������ijɷ��Լ����ϼ۵��������������ķ�Ӧ�ǣ�3O2��4Cr��OH��3��4Na2CO3![]() 4Na2CrO4��4CO2����6H2O��������Ϣ����Al2O3��Na2CO3
4Na2CrO4��4CO2����6H2O��������Ϣ����Al2O3��Na2CO3![]() 2NaAlO2��CO2��ZnO��Na2CO3
2NaAlO2��CO2��ZnO��Na2CO3![]() Na2ZnO2��CO2�����ˮ�������ʺ���NaAlO2��Na2ZnO2����2��ƫ�����ƺ����ᷢ����AlO2����H����H2O=Al��OH��3����Na2ZnO2�����ᷢ����Ӧ��ZnO22����2H��=Zn��OH��2������������ͼ�������CrO42��ת����Cr2O72�����������������ǣ���ȥ��Һ��NaAlO2��Na2ZnO2���ʣ���CrO42��ת����Cr2O72������3�������ظ����ƺ������Ƶ��ܽ�ȣ�ϵ�в���������Ũ������ȴ�ᾧ����4�������������Һ��Crԭ�ӵ����ʵ���Ϊ23.4/52mol=0.45mol����8/9��Crת����Cr2O72������ת����Cr2O72����Cr�����ʵ���Ϊ8��0.45/9mol=0.4mol����Cr2O72�������ʵ���0.4/2mol=0.2mol��c��Cr2O72����=0.2/1mol��L��1=0.2mol��L��1����5��CrO5�к��й���������˴˷�Ӧ����������ԭ��Ӧ����˷�Ӧ����ʽΪ��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��
Na2ZnO2��CO2�����ˮ�������ʺ���NaAlO2��Na2ZnO2����2��ƫ�����ƺ����ᷢ����AlO2����H����H2O=Al��OH��3����Na2ZnO2�����ᷢ����Ӧ��ZnO22����2H��=Zn��OH��2������������ͼ�������CrO42��ת����Cr2O72�����������������ǣ���ȥ��Һ��NaAlO2��Na2ZnO2���ʣ���CrO42��ת����Cr2O72������3�������ظ����ƺ������Ƶ��ܽ�ȣ�ϵ�в���������Ũ������ȴ�ᾧ����4�������������Һ��Crԭ�ӵ����ʵ���Ϊ23.4/52mol=0.45mol����8/9��Crת����Cr2O72������ת����Cr2O72����Cr�����ʵ���Ϊ8��0.45/9mol=0.4mol����Cr2O72�������ʵ���0.4/2mol=0.2mol��c��Cr2O72����=0.2/1mol��L��1=0.2mol��L��1����5��CrO5�к��й���������˴˷�Ӧ����������ԭ��Ӧ����˷�Ӧ����ʽΪ��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ��̶�Ϊ2L���ܱ������г���9.6mol NO��4.8molO2���������·�Ӧ��
��2NO(g)+O2(g)![]() 2NO2(g) ��H<0
2NO2(g) ��H<0
��2NO2(g)![]() N2O4(g) ��H<0
N2O4(g) ��H<0
��÷�Ӧ����ƽ��ʱNO2Ũ��Ϊ1.2 mol/L��N2O4��Ũ��Ϊ0.8 mol/L����Ӧ���Ļ�ѧƽ�ⳣ��Ϊ( )
A�� 0.24 B��0.36 C��1.44 D��l.96
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��H2(g)+Br2(g)=2HBr(g) ��H��-72 kJ��mol-1��������������±���

�����aΪ230
B����֪��H+(aq)+OH-(aq)=H2O(l)��H��-57.3kJ��mol-1
����![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l)��H��-57.3kJ��mol-1
BaSO4(s)+H2O(l)��H��-57.3kJ��mol-1
C����֪CH4(g)+2O2(g)=CO2(g)+2H2O(g)��H��-802.33kJ��mol-1����CH4��ȼ����Ϊ802.33kJ��mol-1
D����֪2C(s)+2O2(g)=2CO2(g)��H1��2C(s)+O2(g)=2CO(g)��H2����H1>��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˹����������M�������ػ���ɹ���������������������Ԥ������������õ����ػ��ʹ�õ�����Һ��Ϊȼ�ռ���Һ��Ϊ�������ĸ��ܵ����ƽ�������֪��
��1��H2��g��=H2��l����H1=��0.92kJmol��1
��2��O2��g��=O2��l����H2=��6.84kJmol��1
��3����ͼ������˵����ȷ���ǣ� ��
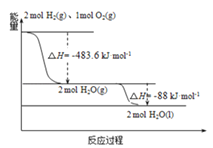
A. 2mol H2��g����1mol O2��g���������������2molH2O��g���������������
B. ������ȼ����Ϊ��H=��241.8 kJmol��1
C. ���Һ��ȼ�յ��Ȼ�ѧ����ʽ2H2��l��+O2��l���T2H2O��g����H=��474.92kJmol��1
D. H2O��g�����H2O��l���Ĺ����У��ϼ����յ�����С�ڳɼ��ų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��WΪ����ǰ������Ԫ�أ����ǵ�ԭ��������������A��Dͬ���壬���γ�DA�����ӻ����B��Cͬ���������ڣ�C��Eͬ���壬E2����Arԭ�Ӿ�����ͬ�ĵ��Ӳ�ṹ��W�ĺϽ����������;��㡣��ش��������⣺
��1��WԪ����Ԫ�����ڱ��е�λ��Ϊ ��
��2������˵����ȷ���ǣ� ��
A��ԭ�Ӱ뾶��A<B<C<D<E
B��D2WC4�����������������;�ˮ��
C��A4B2C3�мȺ������Ӽ��ֺ��й��ۼ�
D��D2C2��EC2���Է�Ӧ����D2EC3��C2
��3�����ȵ�̼����B������������Ӧˮ�����Ũ��Һ��Ӧ����ѧ��Ӧ����ʽΪ ��
��4����ʢ��A2C2��Һ���Թ��м��뼸���ữ��WEC4��Һ����Һ����ػ�ɫ��������Ӧ�����ӷ���ʽΪ ��һ��ʱ�����Һ���д������ݳ��֣������Һ�¶����ߣ��к��ɫ�������ɣ���������ݵ�ԭ���� �����ɳ�����ԭ���� ����ƽ���ƶ�ԭ�����ͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. Ca��C��O��Mn B. H��O��K��Fe
C. P��N��C��Mo D. N��S��O��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300 mL A12��S04��3 ��Һ�У��� Al3+Ϊ 1.62 g���ڸ���Һ�м��� 0.1 molL-1 Ba��OH��2��Һ100 mL����Ӧ����Һ��SO42-�����ʵ���Ũ��ԼΪ
A��0.4 molL-1 B��0.3molL-1 C��0.2 molL-1 D��0.1 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH��4�������pH��10�İ�ˮ�������Ϻ�������Һ��pHֵ
A. һ������7 B. һ������7 C. һ��С��7 D. ���ܴ���7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ķ��ȴ�����6��ͬ���칹�壬������ȴ����ͬ���칹�����ĿΪ��������
A. 4�� B. 5�� C. 6�� D. 8��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com