
【题目】桂皮酸是从肉桂皮中分离出的有机酸,广泛应用于精细化工品的生产。桂皮酸的一条成路线如下,部分需要的试剂或条件略去:

已知:

(1)D中官能团名称为___________________,反应IV的反应类型为______________________。
(2)写出反应I的化学方程式__________________________________________
(3)写出桂皮酸的结构简式____________________________________________
(4)为检验D是否已经完全转化为桂皮酸,所用试剂和实验条件是_________________________。
(5)写出同时满足下列三个条件的C的同分异构体的结构简式__________________
①属于芳香族化合物 ②核磁共振氢谱为四组峰 ③能与 NaHCO3溶液反应产生气体
【答案】碳碳双键、醛基 消去反应 ![]() +2Cl2
+2Cl2![]()
![]() +2HCl
+2HCl ![]() 新制的Cu(OH)2悬浊液、加热(或银氨溶液、加热) :
新制的Cu(OH)2悬浊液、加热(或银氨溶液、加热) : 、
、
【解析】
本题为有机推断题。根据B的分子式可知B为卤代烃,B在氢氧化钠、水、加热条件下发生卤代烃的水解生成醇,此醇发生信息提示中的反应生成![]() ,由此醛可逆推醇为
,由此醛可逆推醇为![]() ,B为
,B为![]() ,A为
,A为![]() ,A生成B的反应为取代反应;
,A生成B的反应为取代反应;![]() 与CH3CHO、稀NaOH条件下发生加成反应生成C,C经反应Ⅳ生成D,D的分子式为C9H8O,根据C的结构简式和D的分子式可推知此反应为消去反应,反应条件为氢氧化钠的醇溶液加热,D的结构简式为
与CH3CHO、稀NaOH条件下发生加成反应生成C,C经反应Ⅳ生成D,D的分子式为C9H8O,根据C的结构简式和D的分子式可推知此反应为消去反应,反应条件为氢氧化钠的醇溶液加热,D的结构简式为![]() ,D经反应Ⅴ生成桂皮酸,根据桂皮酸的分子式可推知此反应Ⅴ为氧化反应,桂皮酸的结构简式为
,D经反应Ⅴ生成桂皮酸,根据桂皮酸的分子式可推知此反应Ⅴ为氧化反应,桂皮酸的结构简式为![]() ,据此解答。
,据此解答。
根据B的分子式可知B为卤代烃,B在氢氧化钠、水、加热条件下发生卤代烃的水解生成醇,此醇发生信息提示中的反应生成![]() ,由此醛可逆推醇为
,由此醛可逆推醇为![]() ,B为
,B为![]() ,A为
,A为![]() ,A生成B的反应为取代反应;
,A生成B的反应为取代反应;![]() 与CH3CHO、稀NaOH条件下发生加成反应生成C,C经反应Ⅳ生成D,D的分子式为C9H8O,根据C的结构简式和D的分子式可推知此反应为消去反应,反应条件为氢氧化钠的醇溶液加热,D的结构简式为
与CH3CHO、稀NaOH条件下发生加成反应生成C,C经反应Ⅳ生成D,D的分子式为C9H8O,根据C的结构简式和D的分子式可推知此反应为消去反应,反应条件为氢氧化钠的醇溶液加热,D的结构简式为![]() ,D经反应Ⅴ生成桂皮酸,根据桂皮酸的分子式可推知此反应Ⅴ为氧化反应,桂皮酸的结构简式为
,D经反应Ⅴ生成桂皮酸,根据桂皮酸的分子式可推知此反应Ⅴ为氧化反应,桂皮酸的结构简式为![]() ;
;
(1)根据上述分析D的结构简式为![]()
(2)根据上述分析A为![]() ,A与氯气、光照生成B,B为
,A与氯气、光照生成B,B为![]() ,此反应为取代反应,方程式为
,此反应为取代反应,方程式为![]() +2Cl2
+2Cl2![]()
![]() +2HCl。本小题答案为:
+2HCl。本小题答案为:![]() +2Cl2
+2Cl2![]()
![]() +2HCl。
+2HCl。
(3)根据上述分析可知桂皮酸的结构简式为![]() 。本小题答案为:
。本小题答案为:![]() 。
。
(4)D为醛,根据醛的特性进行检验,加入新制的氢氧化铜悬浊液、加热会出现砖红色沉淀;或加入银氨溶液、加热有光亮的银析出。本小题答案为:新制的Cu(OH)2悬浊液、加热(或银氨溶液、加热)。
(5)满足下列三个条件的C的同分异构体应为:①属于芳香族化合物含有一个苯环 ②核磁共振氢谱为四组峰含有4中等效氢③能与 NaHCO3溶液反应产生气体含有一个-COOH,则此同分异构体为 、
、 。本小题答案为:
。本小题答案为: 、
、 。
。


科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钾是一种重要的无机氟化工产品,广泛应用于医药、农药和金属冶炼等领域。采用湿法磷酸副产物氟硅酸(![]() ,含有少量
,含有少量![]() 、
、![]() 等)制备氟化钾的工艺流程如图所示(已知:
等)制备氟化钾的工艺流程如图所示(已知:![]() ):
):

请回答下列问题:
(1)碱解过程主要反应的化学方程式为_____,其中要严格控制KOH用量,否则易生成副产物_____(填化学式)溶解在滤液中。
(2)碱解反应中温度对氟化钾收率的影响如图所示。由如图可知,实验选择适宜的反应温度为____;最高点后,随温度升高曲线下降的原因可能是_______。

(3)Ba(OH)2加入量对![]() 含量和氟化钾纯度的影响如图所示。当
含量和氟化钾纯度的影响如图所示。当![]() 由0.004到0.005时,氟化钾的纯度升高,这是由于__。
由0.004到0.005时,氟化钾的纯度升高,这是由于__。
(4)Ba(OH)2和BaCO3是常见的除硫试剂。若使用BaCO3代替Ba(OH)2,当沉淀转化达到平衡时,滤液中![]() ___[已知
___[已知![]() ,
,![]() ,保留小数点后三位]。
,保留小数点后三位]。
(5)浓度均为0.1mol/L的KF和HF的混合溶液中:2c(H+)-2c(OH-)____c(F-)-c(HF) (填“>”“<”或“=”)。
(6)1986年,化学家Karl Chrite用KMnO4和KF、HF混合溶液反应生成稳定配离子![]() ,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
,该反应氧化产物是一种常见的无色无味气体单质,则该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把氢氧化钙放入蒸馏水中,一定时间后达到下列溶解平衡:Ca(OH)2 (s) ![]() Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
A. CaCl2 B. NaHCO3 C. NaOH D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
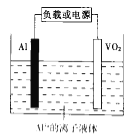
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2![]() H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1
⑴ 写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式: __________________。
⑵ 反应A可自发进行的温度条件是________(填“低温”或“高温”) 。
⑶ 写出两个有利于提高反应A中甲醇平衡产率的条件___________。
⑷ 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

温度对反应的影响 压强对反应的影响
① 由上图可知,影响产物选择性的外界条件是______。
A. 温度 B. 压强 C. 催化剂
② 如图中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为________________(用分数表示)。
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

⑸ 阳极反应式为__________________________________。
⑹ 除去NH4+的离子反应方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】口服抗菌药利君沙的制备原料E和某种广泛应用于电子电器领域的高分子化合物H的合成路线如下:
已知:

I、核磁共振氢谱显示E分子中有两组峰,且峰面积比为2:1
Ⅱ、![]()
![]()
![]()
Ⅲ、
回答下列问题:
(1)丙烯的结构简式为_______________;E的分子式为_____________________;
(2)B分子中官能团的名称为__________________;G的名称为_______________________。
(3)由甲苯生成F的反应类型为_________________。
(4)写出C→D的化学方程式________________________________________________。
(5)满足下列条件的G的同分异构体有_________种。
①苯环上有三个取代基。②遇![]() 溶液发生显色反应。
溶液发生显色反应。
③能和![]() 溶液反应生成
溶液反应生成![]() 。
。
(6)写出1,3-丁二烯(![]() )和乙二醇(
)和乙二醇(![]() )为某原料制备聚酯纤维
)为某原料制备聚酯纤维 的合成路线________________(无机试剂任选)。
的合成路线________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com