
| A.核外电子数 | B.质子数 | C.电子层数 | D.最外层电子数 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:填空题
 ,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氡气在标准状况下密度约是19.82g·L-1 |
| B.氡气化学性质较活泼,因此对人体有害 |
| C.氡原子核外有7个电子层,最外层有8个电子 |
| D.“锕射气”是氡的同位素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. 和 和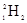 互为同位素,性质相似 互为同位素,性质相似 |
| B.元素的性质随着原子序数的递增呈周期性变化 |
| C.化学反应遵循质量守恒定律相能量守恒定律 |
| D.溶液、浊液、胶体的本质区别是分散质微粒大小不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

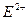 B.R+ C.T3+ D.
B.R+ C.T3+ D.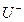
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ;
; 件下制取常见果实催熟剂的化学方程式:
件下制取常见果实催熟剂的化学方程式: :
: (C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)回答:
(C6Li表示锂原子嵌入石墨形成的复合材料,LiMO2表示含锂的过渡金属氧化物)回答: -xe-=C6Li1-x+xLi+,则正极反应为: ;⑵电池放电时若转移1mol e-,消
-xe-=C6Li1-x+xLi+,则正极反应为: ;⑵电池放电时若转移1mol e-,消 耗的负极材料 g。
耗的负极材料 g。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题:
同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素的最外层电子数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元素。试回答下列问题: (选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
(选填代号:A.离子键 B.极性键 C.非极性键 D.配位键)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com