
从薄荷油中得到一种烃A(C10H16),叫α非兰烃,与A相关反应如下:
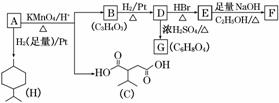
已知: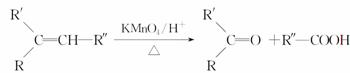
(1)H的分子式为________。
(2)B所含官能团的名称为________。
(3)含两个—COOCH3基团的C的同分异构体共有____________种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为___________________________。
(4)B→D,D→E的反应类型分别为________、________。
(5)G为含六元环的化合物,写出其结构简式: _____________________________。
(6)F在一定条件下发生聚合反应可得到一种高吸水性树脂,该树脂名称为________。
(7)写出E→F的化学反应方程式: ________________________________________
________________________________________________________________________。
(8)A的结构简式为________,A与等物质的量的Br2进行加成反应的产物共有________种(不考虑立体异构)。
科目:高中化学 来源: 题型:
糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。下列说法正确的是( )
A.蛋白质中只含有C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.牛油、大豆油的主要成分都是高级脂肪酸甘油酯
D.糖类、油脂、蛋白质一定都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有关 分子结构的下列叙述中正确的是( )
分子结构的下列叙述中正确的是( )
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上
A.①② B.②③
C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式与苯丙氨酸(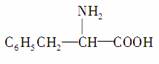 )相
)相
同,且同时符合下列两个条件:①有带两个取代基的苯环;②有一个硝基直接连接在苯环上。那么,这种物质的异构体的数目是( )
A.3种 B.5种
C.6种 D.10种
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2CO3溶液中:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H12O其中含有2个甲基的醇与分子式为C5H10O2的酸发生酯化反应得到的有机物可能的结构有(不包括立体异构)
A.24种 B.16种 C.12种 D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
①写出CO2与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
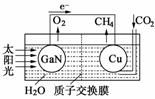
② 科学家用氮化镓材料与铜组装如右图的人工光合系统,
利用该装置成功地实现了以CO2和H2O合成CH4。
写出铜电极表面的电极反应式 。为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
③ 另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)
CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入
空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
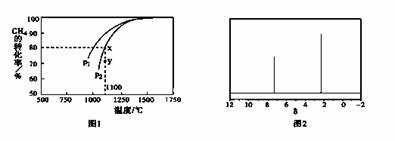
在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”
或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如下图2,则X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的。
已知: 氧化性: IO3— >Fe3+ >I2 还原性:S2O32— > I—
反应式:3I2 + 6OH— == 5I— + IO3— + 3H2O KI + I2 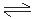 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)。用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色。
① 该红色物质是 (用化学式表示);CCl4中显示紫红色的物质是 (用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为 ; 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A. Na2S2O3 B. AlCl3 C. Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com