


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、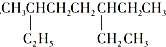 和 和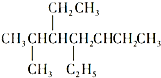 ,主链上碳原子数均为7个 ,主链上碳原子数均为7个 |
| B、主链含5个碳原子,有甲基、乙基2个支链的烷烃有三种 |
| C、新戊烷、正丁烷、异丁烷和丙烷的熔沸点依次降低 |
| D、C7H16的烷烃中,含有3个甲基的同分异构体有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两个原子形成共价键时至少有1个σ键 |
| B、MgCl2分子中存在3个共价键 |
| C、N2分子中有2个σ键,1个π键 |
| D、键的强度大,含有该键的物质比较活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com