
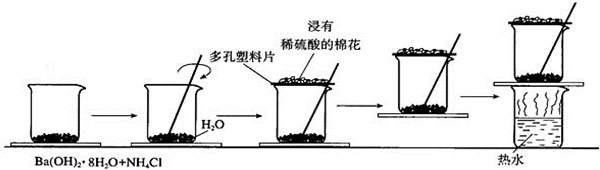
分析 (1)玻璃棒的搅拌作用是使混合物混合均,让化学反应快速发生;
(2)氢氧化钡和氯化铵反应生成氯化钡、氨气和水,据此写出反应的化学方程式;
(3)根据四种基本反应类型的概念及该反应特点进行判断;
(4)烧杯和玻璃片之间的水结冰会将二者粘在一起则说明反应是一个吸热反应,反应物的总能量小于生成物的总能量;
(5)氨气对人有害,不能直接排放,需要进行尾气吸收.
解答 解:(1)Ba(OH)2•8H2O晶体和氯化铵晶体之间的反应是固体之间的反应,搅拌可使混合物充分接触并发生反应,
故答案为:搅拌,使混合物混合均匀;
(2)氢氧化钡和氯化铵反应生成氯化钡、氨气和水,反应的化学方程式为:Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O,
故答案为:Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;
(3)反应Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O中,两种化合物反应生成另外两种化合物,属于复分解反应,
故答案为:复分解;
(4)通过玻璃片上结冰现象或烧杯和底部的玻璃片粘在一起或用手触摸烧杯外壁有冰凉的感觉,可以知道氢氧化钡晶体和氯化铵之间的反应是吸热的,反应物的总能量小于生成物的总能量,
故答案为:吸热;
(5)该反应中有氨气生成,氨气对人体有害的气体,会对环境造成污染,所以不能直接排放到大气中,应该所以完全吸收装置,可以使用稀硫酸吸收,
故答案为:吸收反应中产生的氨气.
点评 本题考查探究化学反应中的能量变化,题目难度中等,明确化学反应与能量变化的关系为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子中共价键键能越高,键长越长,则分子越稳定 | |
| B. | 元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键 | |
| C. | 水分子可表示为H-O-H,分子中键角为180° | |
| D. | N-N、N=N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡不移动 | |
| B. | 再达平衡时,n(A):n(B):n(C)仍为2:2:1 | |
| C. | 再达平衡时,C的体积分数增大 | |
| D. | 若将容器改为恒压容器,则平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 1 mol的甲基与1 mol的铵根离子所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | HOOC-COOH | C. | HOCH2CH2OH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com