
分析 (1)准确称量3.92g晶体溶于适量的稀硫酸,配成100mL浅绿色溶液X,判断溶液中含有亚铁离子;A晶体是一种矾证明是硫酸盐,溶解后溶液中含有硫酸根离子;
(2)取少量X于试管中滴加KSCN溶液,无现象,再滴加氯水,溶液呈红色,证明晶体中无三价铁离子只含有亚铁离子;
(3)取少量X于试管中加入浓NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝,证明含有铵根离子;
(4)取20.00mLX于锥形瓶中,用0.02mol/LKMnO4溶液滴定(酸性KMnO4被还原成Mn2+,Mn2+在溶液中几乎呈无色),当到达终点时,用去KMnO4溶液20.00mL;依据5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,定量关系计算亚铁离子物质的量为0.002mol;则100ml中 含有0.01mol;
(5)取20.00mLX于试管中加入浓NaOH溶液加热,生成的气体能使湿润的红色石蕊试纸变蓝,证明含有铵根离子,且恰好能被20.00mL0.10mol/LH2SO4溶液完全吸收,发生反应NH3+HCl=NH4Cl,则溶液中含铵根离子物质的量为0.004mol;则100ml溶液中含NH4+物质的量为0.02mol;
(6)另取20.00mLX向其中加入足量的BaCl2溶液,将沉淀过滤、洗涤、烘干、称量得1.00g为硫酸钡沉淀;
(1)依据实验步骤分析判断实验目的是判断晶体组成;
(2)依据①②判断盐为钒是硫酸盐,配制浅绿色溶液为亚铁离子的颜色;加入酸中溶解是为了抑制亚铁离子的水解;
(3)依据滴定实验中 标准液装入滴定管的操作分析,滴定管用待装液润洗2-3次,调整液面钱排净尖嘴玻璃管处的气泡,;
(4)依据题干信息和实验步骤,结合(6)的要求分析,实验目的是沉淀A的组成;
(5)不能排除阴离子的干扰,依据硫酸根离子的检验方法进行沉淀;
(6)依据实验现象判断含有铵根离子、亚铁离子、硫酸根,结合滴定实验数据和沉淀固体沉淀质量计算各离子物质的量写出化学式.
解答 解:(1)准确称量3.92g晶体溶于适量的稀硫酸,配成100mL浅绿色溶液X,判断溶液中含有亚铁离子;A晶体是一种矾证明是硫酸盐,溶解后溶液中含有硫酸根离子;
(2)取少量X于试管中滴加KSCN溶液,无现象,再滴加氯水,溶液呈红色,证明晶体中无三价铁离子只含有亚铁离子;
(3)取少量X于试管中加入浓NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝,证明含有铵根离子;
(4)取20.00mLX于锥形瓶中,用0.02mol/LKMnO4溶液滴定(酸性KMnO4被还原成Mn2+,Mn2+在溶液中几乎呈无色),当到达终点时,用去KMnO4溶液20.00mL;依据5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,定量关系计算亚铁离子物质的量为0.002mol;则100ml中 含有0.01mol;
(5)取20.00mLX于试管中加入浓NaOH溶液加热,生成的气体能使湿润的红色石蕊试纸变蓝,证明含有铵根离子,且恰好能被20.00mL0.10mol/LH2SO4溶液完全吸收,发生反应NH3+HCl=NH4Cl,则溶液中含铵根离子物质的量为0.004mol;则100ml溶液中含NH4+物质的量为0.02mol;
(1)上述分析可知A中所含的阳离子是NH4+、Fe2+;所含的阴离子为SO42-,
故答案为:NH4+、Fe2+;SO42-;
(2)钒是硫酸盐,配制浅绿色溶液为亚铁离子的颜色;加入酸中溶解是为了抑制亚铁离子的水解,避免亚铁离子水解变浑浊;
故答案为:抑制Fe2+的水解;
(3)滴定管用待装液润洗2-3次,用0.02mol/LKMnO4溶液滴定,高锰酸钾溶液装在酸式滴定管中,所以酸式滴定管需要用0.02mol/LKMnO4溶液润洗滴定管两次,调整液面钱排净尖嘴玻璃管处的气泡,
a.用特制洗涤液选涤;
b.用自来水冲洗后,用蒸馏水洗涤;
c.再用 标准液(KMnO4溶液)润洗两次;
d.装入标准溶液后,赶走滴定管中的下端的空气泡;
e.调节标准液的液面在“0”或“0”刻度以下,固定在滴定架上.
故答案为:标准液(KMnO4溶液);赶走滴定管中的下端的空气泡;
(4)依据题干信息和实验步骤,结合(6)的要求分析,实验目的是沉淀A的组成,此实验的名称是:氧化还原法滴定,测定A矾的组成,
故答案为:氧化还原法滴定,测定A矾的组成;
(5)第(6)步直接加入过量氯化钡,沉淀会有其他离子干扰,不一定是硫酸钡沉淀,所以应先加入稀盐酸排除其他离子的干扰,在加入过量氯化钡溶液全部沉淀硫酸根离子生成硫酸钡沉淀,过滤、洗涤后称重;
故答案为:(6);直接取一定量A向其中加入稀盐酸,再加入足量的BaCl2溶液,将沉淀过滤、洗涤,反复烘干并称量沉淀的质量.
(6)①准确称量3.92g晶体溶于适量的稀硫酸,配成100mL浅绿色溶液X,判断溶液中含有亚铁离子;A晶体是一种矾证明是硫酸盐,溶解后溶液中含有硫酸根离子;
②取少量X于试管中滴加KSCN溶液,无现象,再滴加氯水,溶液呈红色,证明晶体中无三价铁离子只含有亚铁离子;
③取20.00mLX于锥形瓶中,用0.02mol/LKMnO4溶液滴定(酸性KMnO4被还原成Mn2+,Mn2+在溶液中几乎呈无色),当到达终点时,用去KMnO4溶液20.00mL;依据5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,定量关系计算亚铁离子物质的量为0.002mol;则100ml中 含有0.01mol;
④取20.00mLX于试管中加入浓NaOH溶液加热,生成的气体能使湿润的红色石蕊试纸变蓝,证明含有铵根离子,且恰好能被20.00mL0.10mol/LH2SO4溶液完全吸收,发生反应NH3+HCl=NH4Cl,则溶液中含铵根离子物质的量为0.004mol;则100ml溶液中含NH4+物质的量为0.02mol;
通过实验测得3.92g晶体中含有的阴离子全部形成钡盐沉淀的质量为4.66g,通过以上分析判断阴离子为硫酸根离子生成沉淀为硫酸钡沉淀,计算含有硫酸根离子物质的量为0.02mol;
3.92g晶体中含Fe2+离子物质的量为0.01mol,质量为0.56g;NH4+物质的量为0.02mol,质量为0.36g;SO42-物质的量0.02mol,质量为1.92g;依据晶体质量可知含结晶水的质量=3.92g-0.56g-0.36g-1.92g=1.08g;物质的量为0.06mol,则化学式为n(NH4+):n(Fe2+):n(SO42-):n(H2O)=0.02:0.01:0.02:0.06=2:1:2:6,则化学式为:(NH4)2Fe(SO4)2•6H2O;
故答案为:(NH4)2Fe(SO4)2•6H2O;
点评 本题考查了物质定量测定的实验方法应用,物质性质的分析判断,质量守恒的应用,实验现象的判断,化学式的计算应用主要考查亚铁离子、铵根离子、硫酸根离子、钒的检验和理解,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| B. | 稀盐酸和硅酸钠溶液反应:SiO32-+2H+═H2SiO3↓ | |
| C. | 碳酸钙和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中含有的化学键类型为离子键和共价键.
,其中含有的化学键类型为离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1:1 | B. | 1:1:2 | C. | 1:2:3 | D. | 2:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | Cl2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | MgCl2 |
| D | CO2 | SO2 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可以净水:Al3++3H2O=Al(OH)3(胶体)↓+3H+ | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO-3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成的水22g,其中所含的中子数为11 NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4 L,质量为28 g | |
| C. | 标准状况下,22.4LNO和11.2L O2混合后气体的原子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
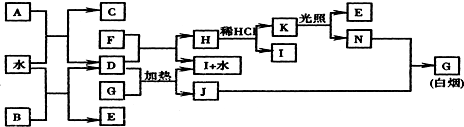
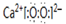 ;K的结构式是H-O-Cl.
;K的结构式是H-O-Cl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
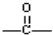
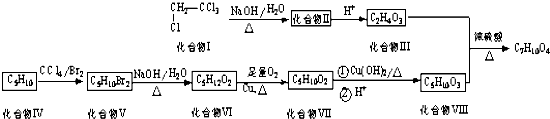
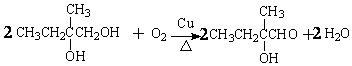 .
.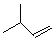 ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为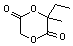 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com