
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
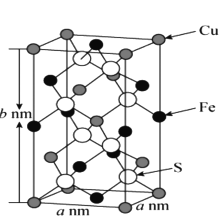
【答案】16 1s22s22p63s23p63d6(或[Ar]3d6) 三角锥形 N2或CO CuCl为分子晶体,CuF为离子晶体,离子晶体的熔沸点比分子晶体高 sp3 低 乙醇分子间有氢键,而乙硫醇没有 CuFeS2 ![]()
【解析】
(1)硫元素为16号元素,核外有16个电子,9个轨道;铁为26号元素,核外有26个电子,失去最外层的2个电子变成Fe2+;
(2)根据SO32-的杂化方式为sp3确定它的空间结构,由等电子体定义确定SO2+的等电子体的分子;
(3)根据两种晶体的性质确定晶体类型;
(4)根据乙硫醇中硫原子的成键特点判断杂化方式,乙醇分子里有氧,可以形成氢键导致沸点比较高;
(5)根据晶胞结构中Cu、Fe、S原子个数计算出化学式,再由有关公式写出晶胞密度的表达式;
根据以上分析进行解答。
(1)基态原子核外有多少个轨道就有多少个空间运动状态。硫原子的电子排布式为:1s22s22p63s23p4,故硫原子1+1+3+1+3=9个轨道,所以基态硫原子中核外电子有9种空间运动状态;Fe是26号元素,核外有26个电子,铁原子失去最外层的两个电子变成Fe2+,Fe2+的电子排布式是1s22s22p63s23p63d6(或[Ar]3d6)。
答案为:9;1s22s22p63s23p63d6(或[Ar]3d6)。
(2)SO32-离子中的硫原子有三个化学键,一对孤对电子,属于sp3杂化,空间构型为三角锥形;SO2+有两个原子,总价电子数为10,与SO2+互为等电子体的分子有N2、CO等。
答案为:三角锥形;N2或CO。
(3)由题知CuCl熔点为426℃,融化时几乎不导电,可以确定CuCl为分子晶体,熔沸点比较低,CuF的熔点为908℃,沸点1100℃,确定CuF为离子晶体,熔沸点比较高。
答案为:CuCl为分子晶体,CuF为离子晶体,离子晶体的熔沸点比分子晶体高。
(4)乙硫醇(C2H5SH)里的S除了共用的两对电子外还有两对孤对电子要参与杂化,所以形成的是sp3杂化,乙醇里有电负性较强的氧原子,分子间可以形成氢键,沸点比乙硫醇的沸点高。
答案:sp3;低;乙醇分子间有氢键,而乙硫醇没有。
(5)对晶胞结构分析可知,晶胞中的Cu原子数目=8![]() +4
+4![]() +1=4,Fe原子数目=6
+1=4,Fe原子数目=6![]() +4
+4![]() =4,S原子数目为8, X的化学式中原子个数比为:Cu:Fe:S=1:1:2,所以X的化学式为:CuFeS2。
=4,S原子数目为8, X的化学式中原子个数比为:Cu:Fe:S=1:1:2,所以X的化学式为:CuFeS2。
由图可知晶胞内共含4个“CuFeS2”,据此计算:晶胞的质量=4![]() =
=![]() ,晶胞的体积V=anmanmbnm=a2b10-21cm3,所以晶胞的密度=
,晶胞的体积V=anmanmbnm=a2b10-21cm3,所以晶胞的密度=![]() =
= 。
。
答案为:CuFeS2;![]() 。
。


科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中的电离方程式:
CH3COOH____HClO4_____
Fe(OH)3____Ba(OH)2_____
NaHSO4____
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:___。
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于___。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙炔为原料,根据以下流程信息,制备有机物F;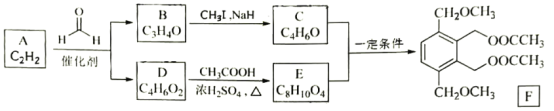
已知: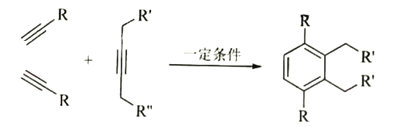
回答以下问题:
(1)A的化学名称为___。
(2)B的结构简式为___,C中官能团的名称是___。
(3)由A生成D的反应类型为___。
(4)由C和E生成F的化学方程式为____。
(5)芳香化合物X是E的同分异构体,可与FeCl3溶液发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为6:2:2。写出两种符合要求X的结构简式____、___。
(6)写出以1—溴—2—苯基乙烷为原料制备化合物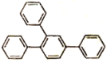 的合成销路线(其他试剂任选)。___。
的合成销路线(其他试剂任选)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全氮类物质因具有超高能量而成为超高含能材料的典型代表。我国科学家成功合成了全氮阴离子盐——(N5)6(H3O)3(NH4)4Cl,是该领域的重大突破。
(1)氮的原子结构示意图为________。
(2)构成该全氮阴离子盐的离子是Cl-、H3O+、NH4+和________。
(3)氯与氢之间的作用对全氮阴离子盐的稳定性起着至关重要的作用。结合原子结构解释氯元素非金属性强的原因:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com