
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为______mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为______mol·L-1。
②需用浓硫酸的体积为________mL。
【答案】4 0.04 C 4.6 250
【解析】
(1)c(NaClO)![]()
故答案为:4.0;
(2)稀释后c(NaClO)= ![]() ×4.0molL1=0.04molL1,
×4.0molL1=0.04molL1,
故答案为:0.04;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的 a、 b共2种仪器不需要,但还需玻璃棒和胶头滴管,故A错误;
B. 配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C. 由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D. 实验室中没有480mL规格的容量瓶,因此应选取500mL的容量瓶进行配制,然后取出480mL即可,所以需要NaClO的质量:0.5L×4.0molL1×74.5gmol1=149g,故D错误;
故答案为:C。
(4)①c(H2SO4)=2.3molL1,则c(H+)=4.6molL1,
故答案为:4.6;
②溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=![]() =18.4mol/L,假设需要浓硫酸的体积为V,
=18.4mol/L,假设需要浓硫酸的体积为V,
则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL,
故答案为:250。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值, 下列叙述正确的是
A. 1mol H2O中含有的极性共价键数目为2NA
B. 16 g16O2和18O2混合物中含有的质子数目为8NA
C. Zn和浓硫酸反应得到22.4LSO2和 H2混合气体时, 转移的电子数为4NA
D. 标准状况下2 mol NO与1 mol O2充分反应后分子数共2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需要吸收能量的是( )
A. 1s22s22p63s1→1s22s22p6 B. 3s23p5→3s23p6
C. 2p![]() 2p
2p![]() 2p
2p![]() →2p
→2p![]() 2p
2p![]() 2p
2p![]() D. 2H→H—H
D. 2H→H—H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( )

A.该反应的热化学方程式![]() △H>0
△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用等浓度的NaOH溶液分別滴定相同体积的NH4Cl、KH2PO4及CH3COOH溶液,滴定曲线如图所示,下列说法正确的是( )

A. NH3 ·H2O![]() NH4+ +OH- 的 lg Kb=-9.25
NH4+ +OH- 的 lg Kb=-9.25
B. CH3COOH+HPO42-=CH3 COO-+H2 PO4-的 lg K =2.11
C. 0.1mol/LKH2PO4溶液中:c(HPO42-)<c(H3PO4)
D. 在滴定过程中,当溶液pH相同时,消耗NaOH的物质的量:CH3COOH<KH2PO4<NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?),“?”代表状态未定。反应一段时间后达到平衡,测得生成1. 6 mol C,且反应前后压强之比为5∶4,则下列说法正确的是
4C(?)+2D(?),“?”代表状态未定。反应一段时间后达到平衡,测得生成1. 6 mol C,且反应前后压强之比为5∶4,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K= c4(C).c2(D)/[c3(A).c2(B)]
B. 此时B的平衡转化率是35%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 平衡后再增加1mol C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是

A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH:a>b>c
C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为![]() ,硼砂的化学式为
,硼砂的化学式为![]() 。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
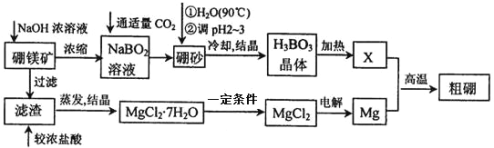
(1)写出硼元素在周期表中的位置_________________________
(2)将硼砂溶于热水后,用硫酸调节溶液的![]() 为23以制取硼酸
为23以制取硼酸![]() ,该反应的离子方程式为_________________________________________。
,该反应的离子方程式为_________________________________________。
(3)由![]() 制备
制备![]() 时,一定条件是_________________________________。
时,一定条件是_________________________________。
(4)制得的粗硼在一定条件下生成![]() ,
, ![]() 加热分解可以得到纯净的单质硼。现将
加热分解可以得到纯净的单质硼。现将![]() 粗硼制成的
粗硼制成的![]() 完全分解,将生成的
完全分解,将生成的![]() 配制成
配制成![]() 溶液,用酸式滴定管量取
溶液,用酸式滴定管量取![]() 碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用
碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。(提示:
。(提示:![]() )滴定终点的现象为____________,该粗硼样品的纯度为____________%
)滴定终点的现象为____________,该粗硼样品的纯度为____________%
Ⅱ (5)已知:![]() 的电离常数为
的电离常数为![]() ,
,![]() 的电离常数为
的电离常数为![]() 、
、![]() ,向盛有饱和硼酸溶液的试管中,滴加
,向盛有饱和硼酸溶液的试管中,滴加![]()
![]() 溶液,_____(填“能”或“不能”)观察到气泡逸出.
溶液,_____(填“能”或“不能”)观察到气泡逸出.
(6)![]() [也可写成
[也可写成![]() ]可以通过电解
]可以通过电解![]() 溶液的方法制备.工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过).
溶液的方法制备.工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过).

①![]() 膜为________交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式: ________________
膜为________交换膜(填“阴离子”或“阳离子”),写出产品室发生反应的离子方程式: ________________
理论上每生成![]() ,阴极室可生成________
,阴极室可生成________![]() 气体(标准状况)
气体(标准状况)
②![]() 室中,进口和出口的溶液浓度大小关系为
室中,进口和出口的溶液浓度大小关系为![]() ________
________![]() (填“>”或“<”)
(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料。用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0
C2H4(g)+4H2O(g) ΔH<0

(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=_________kJ·mol1。(用含a、b的式子表示)
(2)几种化学键的键能如表所示,实验测得上述反应的ΔH= 152 kJ·mol1,则表中的x=___________。
化学键 | C=O | H-H | C=C | C-H | O-H |
键能/(kJ·mol-1) | 803 | 436 | x | 414 | 463 |
(3)向1 L恒容密闭容器中通入1 mol CO2和n mol H2,在一定条件下发生上述反应,测得CO2的转化率α(CO2)与反应温度、投料比X[ n(H2)/n(CO2 )]的关系如图所示。

①X1_________(填“>”、“<”或“=”,下同)X2;
②平衡常数KA_______KB,KB________KC;
③若B点时X=3,则平衡常数KB=_____________(代入数据列出算式即可);
④下列措施能同时满足增大反应速率和提高CO2转化率的是(__________)
a.升高温度 b.加入催化剂 c.增大投料比X d.将产物从反应体系中分离出来

(4)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则N极上的电极反应式为:_______________;该电解池中所发生的总反应的化学方程式为:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com