
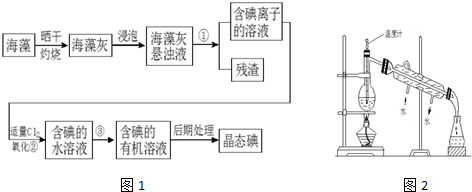
分析 海带晒干灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有机溶液,经蒸馏可得到碘,以此解答该题.
(1)分离固体和液体用过滤;用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来用萃取;萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,据此来选择合适的试剂;
(3)依据过滤、分液操作的实验原理选择合适的仪器;
(4)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平.
解答 解:(1)①分离固体和液体用过滤,利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,③将碘水中的碘单质萃取出来,互不相溶的物质的分离是分液法,过程②中的反应是氯气氧化碘离子生成碘单质,反应的离子方程式为:2I-+Cl2═2Cl-+I2,
故答案为:过滤;萃取分液;2I-+Cl2═2Cl-+I2;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用四氯化碳或直馏汽油,酒精、乙酸等和水是互溶的,不能选择,
故答案为:BD;
(3)为使海藻灰中碘离子转化为碘的有机溶液,根据实验装置原理,基本操作有过滤、萃取分液、使用的仪器有:烧杯、玻璃棒、漏斗,分液漏斗等,尚缺少的玻璃仪器是(普通)漏斗和分液漏斗,
故答案为:(普通)漏斗和分液漏斗.
(4)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平.
故答案为:缺少石棉网;温度计的水银球插到液面以下;冷凝管中进出水方向颠倒.
点评 本题考查物质的分离和提纯,学习中注意掌握过滤、萃取、蒸馏等操作要点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大容器体积 | B. | 通入大量O2 | C. | 移去部分SO2 | D. | 降低体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com