
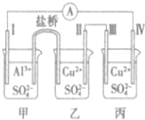
 某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )
某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( )| A. | 甲为原电池,乙、丙均为电解池 | |
| B. | 电子流动方向:电极Ⅳ→A→电极I | |
| C. | 当0.1mol电子转移时,电极I和电极Ⅳ的质量差为4.1g | |
| D. | 若丙中的电解质改为CuCl2,电极Ⅲ的电极反应发生改变 |
分析 电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析解答.
解答 解:电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,
A.电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,所以甲乙构成原电池,丙为电解池,故A错误;
B.电子从负极沿导线流向正极,即电极Ⅰ→A→电极Ⅳ,故B错误;
C.Ⅰ是负极反应式为Al-3e-═Al 3+质量减少,电极Ⅳ是阴极,发生反应为Cu 2++2e-=Cu,质量增加,所以当0.1mol电子转移时,电极I和电极Ⅳ的质量差为$\frac{27}{3}$×0.1+$\frac{64}{2}$×0.1=4.1g,故C正确;
D.电极Ⅲ为阳极,电极反应式为Cu-2e-═Cu 2+,不受电解质溶液改变,故D错误;
故选C.
点评 本题考查了原电池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
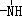 、
、 一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.
一定条件下都可以和H+结合.则N4和足量的H+反应生成的粒子的化学式为N4H44+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠熔化成小球 | |
| B. | 钠块沉在乙醇液面的下面 | |
| C. | 钠块在乙醇的液面上游动 | |
| D. | 钠块表面有气泡放出,有轻微爆炸产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该方案能够计算出“钾泻盐”中KCl的质量分数 | |
| B. | 足量Ba(NO3)2溶液是为了与MgSO4充分反应 | |
| C. | “钾泻盐”化学式中x=3 | |
| D. | 上述实验数据的测定利用学校实验室里的托盘天平即可完成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )| A. | 石墨Ⅱ电极为正极 | |
| B. | Y为N2O5 | |
| C. | 石墨Ⅰ电极方程式为NO+O2--2e-=NO2 | |
| D. | 不能用NaNO3水溶液代替熔融NaNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com