
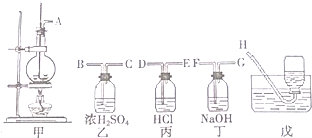
| A. | 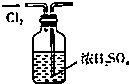 干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. | 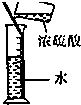 稀释浓H2SO4 | D. | 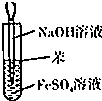 制取Fe(OH)2沉淀 |
分析 A.干燥气体时导气管应该遵循“长进短出”原则;
B.HCl极易溶于水而产生倒吸现象;
C.量筒只能量取溶液不能稀释或溶解药品;
D.苯密度小于水,所以苯和水溶液混合时位于上方,且常温下苯和空气不反应,则苯能隔绝空气.
解答 解:A.干燥氯气时导气管应该遵循“长进短出”原则,故A错误;
B.HCl极易溶于水,应防倒吸,可以用导致的漏斗,故B错误;
C.量取只能量取溶液,不能在量筒中直接稀释浓硫酸,故C错误;
D.Fe(OH)2易被氧化,因此尽量隔绝空气,苯密度小于水密度,苯和水溶液混合时位于上方,且常温下苯和空气不反应,则苯能隔绝空气,故D正确;
故选D.
点评 本题考查实验方案评价,为高频考点,侧重考查基本操作及物质性质,明确实验原理及仪器的使用方法是解本题关键,注意从操作的规范性及物质性质方面解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
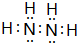 ,Z由两个相同基团构成,该基团的名称是羟基.
,Z由两个相同基团构成,该基团的名称是羟基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH与C6H5COOH为同系物 | |
| B. | 戊烷比丙烷的沸点高 | |
| C. | 烷烃的化学性质与甲烷类似,通常较稳定 | |
| D. | 用燃烧法可鉴别甲烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止水体富营养化.必须控制富含氮、磷污水的排放 | |
| B. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| C. | 根据元索周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| D. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应产生的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg与N2完全反应,转移电子数都是0.3NA | |
| B. | 1mol白磷分子中含有P-P键数为1.5NA | |
| C. | 1.7gH2O2中含有的电子数为0.9NA | |
| D. | 在18g 18O2中含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题:
铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在稀溶液中全部以离子的形式存在 | |
| B. | 常温下,电解质溶液的pH都在0~14之间 | |
| C. | 强电解质的水溶液导电性一定比弱电解质水溶液导电性强 | |
| D. | 弱电解质在水溶液中溶解度都很小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com