
����Ŀ��������Ļ������ڹ�ũҵ�����������о�����ҪӦ�á���ش��������⣺
(1)���������г���N2H4��Ϊ����������ȼ����N2H4�백�����ƣ���һ�ּ������壬������ˮ����������N2H4��H2O���õ��뷽��ʽ��ʾN2H4��H2O�Լ��Ե�ԭ���ǣ�____________________________________________��
(2)�ں��������£�1 mol NO2������C������Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A) ___________Kc(B)(�<����>����=��)
��A��B��C������NO2��ת������ߵ���___________(�A����B����C��)�㡣
������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp=___________MPa(Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
(3)��֪��������(HNO2)���ʺ��������ƣ�������һ�����ᡣ������������ĵ���ƽ�ⳣ��Ka=5.1��10��4��H2CO3��Ka1=4.2��10��7��Ka2=5.61��10��11���ڳ���������2mol̼���Ƶ���Һ�м���1mol��HNO2������Һ��CO32����HCO3����NO2��������Ũ���ɴ�С��˳����______________________��
(4)��֪�������¼װ�(CH3NH2)�ĵ��볣��ΪKb����pKb=��lgKb=3.4ˮ��Һ����CH3NH2+H2OCH3NH3++OH������������CH3NH2��Һ�μ�ϡ������c(CH3NH2)=c(CH3NH3+)ʱ������ҺpH=_______��
(5)һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ��H=+210.5kJ�� mol��1
��CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) ��H=��189.2 kJ�� mol��1
��ӦCaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ��H=___________ kJ�� mol��1
���𰸡�N2H4��H2O![]() N2H5++OH-����N2H4+H2O
N2H5++OH-����N2H4+H2O![]() N2H5++OH-�� = A 2 c(HCO3��)>c(NO2��)>c(CO32��) 10.6 -399.7
N2H5++OH-�� = A 2 c(HCO3��)>c(NO2��)>c(CO32��) 10.6 -399.7
��������
(1) N2H4���H2O�����������ʹ��Һ�ʼ��ԣ�
(2)��ƽ�ⳣ��ֻ���¶�Ӱ�죬�ݴ��жϣ�
������ѹǿƽ�������������С�ķ����ƶ���
����C��ʱ��������̼�����������Ũ����ȣ����ݷ�Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬�ݴ�ȷ�����ɷ�������������������ȷ����Ӧ��ѹǿƽ�ⳣ��Kp��
N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬�ݴ�ȷ�����ɷ�������������������ȷ����Ӧ��ѹǿƽ�ⳣ��Kp��
(3)������볣��Խ������Խǿ�����������ˮ��̶�ԽС��
(4) ����Kb=![]() =c(OH-)���㣻
=c(OH-)���㣻
(5) ���ø�˹���ɽ���-�ٿɵ�CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)��Ӧ�ȡ�
(1)��������ˮ�������백���Ƶ�������������OH-�������ӣ����뷽��ʽΪN2H4��H2O![]() N2H5++OH-��
N2H5++OH-��
��ˣ�������ȷ���ǣ�N2H4��H2O![]() N2H5++OH-��
N2H5++OH-��
(2)��ƽ�ⳣ��ֻ���¶�Ӱ�죬����Kc(A) =Kc(B)��
��ˣ�������ȷ���ǣ�=��
������ѹǿƽ�������������С�ķ����ƶ����÷�Ӧ������Ӧ�������������ķ�Ӧ������A��B��C������NO2��ת������ߵ���A�㣬
��ˣ�������ȷ���ǣ�A��
����C��ʱ��������̼�����������Ũ����ȣ����ݷ�Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬���Ի��������CO2���������Ϊ
N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬���Ի��������CO2���������Ϊ![]() ��NO2���������
��NO2���������![]() ��N2���������
��N2���������![]() �����Է�Ӧ��ѹǿƽ�ⳣ��Kp=
�����Է�Ӧ��ѹǿƽ�ⳣ��Kp=![]() =
= =2MPa��
=2MPa��
��ˣ�������ȷ���ǣ�2��
(3)2mol̼���Ƶ���Һ�м���1mol��HNO2�õ�����1mol̼���ơ�1mol̼�����ƺ�1mol�������ƵĻ��Һ����������ĵ���ƽ�ⳣ��Ka=5.1��10��4��H2CO3��Ka1=4.2��10��7��Ka2=5.61��10��11�����ж�ˮ��̶ȴ�С˳��ΪCO32��> NO2����CO32-ˮ������HCO3����ˮ��ij̶Ƚ�С��������Һ��CO32�����ӡ�HCO3�����Ӻ�NO2�����ӵ�Ũ�ȴ�С��ϵΪc(HCO3��)>c(NO2��)>c(CO32��)��
��ˣ�������ȷ���ǣ�c(HCO3��)>c(NO2��)>c(CO32��)��
(4)���볣��Kbֻ���¶ȸı䣬����ʱ��CH3NH2+H2OCH3NH3++OH�������μ�ϡ������c(CH3NH2)=c(CH3NH3+)ʱ��Kb=![]() =c(OH-)����c(OH-)= Kb=10-3.4mol/L����c(H+)=
=c(OH-)����c(OH-)= Kb=10-3.4mol/L����c(H+)=![]() =10-10.6������pH=-lg10-10.6=10.6��
=10-10.6������pH=-lg10-10.6=10.6��
��ˣ�������ȷ���ǣ�10.6��
(5) ���ø�˹���ɽ���-�ٿɵ�CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)
��H=����189.2 kJ�� mol��1��-��+210.5kJ�� mol��1��=-399.7 kJ�� mol��1��
��ˣ�������ȷ���ǣ�-399.7��


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ھ����˵����ȷ������ǣ� ��
�ٷ��Ӿ����ж����ڹ��ۼ�
���ھ�����ֻҪ�������Ӿ�һ����������
�۽��ʯ��SiC��H2O��H2S������۵����ν���
�����ӻ�������ֻ�����Ӽ�û�й��ۼ������Ӿ����п϶�û�����Ӽ�
��CaTiO3������(�����ṹ��ͼ��ʾ)ÿ��Ti4����12��O2�������
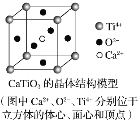
��SiO2������ÿ����ԭ����������ԭ���Թ��ۼ�����
�߾����з��Ӽ�������Խ����Խ�ȶ�
���Ȼ�������ˮʱ���Ӽ����ƻ�
A. �٢ڢۢ�B. �٢ڢ�C. �ۢݢ�D. �ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������糧�ͷų��������������NOx����SO2��CO2���������ɻ������⡣��ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
��1�����������ü������ԭNOx��
CH4(g���� 4NO2(g����4NO(g���� CO2(g���� 2H2O(g�� ��H1����574 kJ/mol
CH4(g���� 4NO(g����2N2(g���� CO2(g���� 2H2O(g�� ��H2����1160 kJ/mol
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ___________��
��2����̼����CO2ת��Ϊ�״���CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g�� ��H3
CH3OH(g)��H2O(g�� ��H3



����һ���º����ܱ������г���1 mol CO2��3 mol H2����������Ӧ�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ1��ʾ���ش�0��10 min�ڣ�������ƽ����Ӧ����Ϊ___mol/(L��min)����10 min�����¶Ȳ��䣬����ܱ��������ٳ���1 mol CO2(g)��1 mol H2O(g)����ƽ��________���������������������������������ƶ���
����ͼ2��25��ʱ�Լ״�ȼ�ϵ�أ��������ҺΪϡ���ᣩΪ��Դ�����300mL ijNaCl��Һ��������ӦʽΪ______���ڵ��һ��ʱ���NaCl��Һ��pHֵ��Ϊ13������NaCl��Һ��������䣩�������������ļ״������ʵ���Ϊ_____mol��
��ȡ��ݵ������CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״��������������CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ������ͼ3��ʾ��������CO2ת��Ϊ�״��ķ�Ӧ����H3____0������������������������������
��3������ȼú��������������̼����һ����������������Ӧ����������李������ˮ��Һ�����Ե�ԭ����______(�����ӷ���ʽ��ʾ)������ʱ����(NH4)2SO4,��Һ�е���NaOH��Һ����Һ�����ԣ���������Һ����Ũ�ȴ�С��ϵc(Na����_____c(NH3��H2O)������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����H��(aq)��OH��(aq)===H2O(l) ��H1����57.3 kJ��mol��1��
��H2(g)��![]() O2(g)===H2O(g) ��H2����241.8 kJ��mol��1�������й�˵����ȷ����( )
O2(g)===H2O(g) ��H2����241.8 kJ��mol��1�������й�˵����ȷ����( )
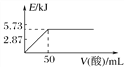
A. ��0.1molNaOH����Һ�м���һ�������0.1mol��L��1�Ҷ��ᣬ��Ӧ�е������仯��ͼ��ʾ
B. H2SO4(aq)��Ba(OH)2(aq)===BaSO4(s)��2H2O(l) ��H����114.6 kJ��mol��1
C. �����ı�ȼ����Ϊ241.8 kJ��mol��1
D. ����Ӧ����ˮΪҺ̬����ͬ�������µķ�Ӧ�ȣ���H>��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���Ӧ�����е������仯��ͼ��ʾ������˵����ȷ����
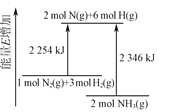
A.NH3�������ϵͣ���N2��H2���ȶ�
B.2NH3(g)��2N(g)��6H(g)��2346 kJ
C.N2(g)��3H2(g)![]() 2NH3(g)��92 kJ
2NH3(g)��92 kJ
D.������������Լ�С��Ӧ����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�İ뵼����ϣ��ǹ����ִ����ӹ�ҵ�Ļ������輰�仯�����ڹ�ҵ��Ӧ�ù㷺���ڹ�ҵ�ϣ��ߴ������ͨ������������ȡ��
![]()
����������:
��1����ԭ�Ӻ�����_______�ֲ�ͬ�����ĵ��ӣ���ԭ�ӵĺ�������Ų�ʽ��_______________��
��2��̼�������ͬ����Ԫ�أ��۷е�SiO2 ________CO2 (��д��>������<����=��)����ԭ����_____________________________________________________��
��3����������SiO2�ƴֹ�ķ�Ӧ����˵��̼�ķǽ�����ǿ�ڹ裬ԭ����_________________����д��һ����˵��̼�ķǽ�����ǿ�ڹ�Ļ�ѧ����ʽ______________________________��
��4��SiHCl3(g) + H2(g)![]() Si(s) + 3HCl(g) ��Q ��Q>0��
Si(s) + 3HCl(g) ��Q ��Q>0��
��������Ӧ��ƽ�ⳣ������ʽK��_____________����ʹK����Ĵ�ʩ��_______________��
��һ�������£��ڹ̶��ݻ����ܱ������У��ܱ�ʾ������Ӧ�ﵽƽ��״̬����________��ѡ���ţ���
a��3v��(SiHCl3)��v��(HCl) b����������ѹǿ����
c��K���ֲ��� d��c(SiHCl3)��c(H2)��c(HCl)��1��1��3
��һ���¶��£���2L�ܱ������н���������Ӧ��5min��ﵽƽ�⣬�˹����й�����������0.28g����ʱHCl�Ļ�ѧ��Ӧ����Ϊ ________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ��屽�ķ�Ӧװ������ͼ��ʾ������ʵ������������������
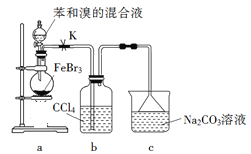
A. ��Բ����ƿ�еμӱ�����Ļ��Һǰ���ȴ�K
B. ʵ����װ��b�е�Һ����Ϊdz��ɫ
C. װ��c�е�̼������Һ�������������廯��
D. ��Ӧ��Ļ��Һ��ϡ����Һϴ�ӡ��ᾧ���õ��屽
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ǿ�ѧ����һֱ��̽�������⣬�����ڹ�ũҵ�������������������Ҫ�����á��ش��������⡣
I.NOx��SO2�ڿ����д�������ƽ�⣺
2NO��g��+O2��g��2NO2��g����H=��113.0kJmol��1
2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1
SO2ͨ���ڶ��������Ĵ����£���һ��������������SO3��
��1��д��NO2��SO2��Ӧ���Ȼ�ѧ����ʽΪ_________��
��2�����¶����ߣ��÷�Ӧ��ѧƽ�ⳣ���仯������_____��
II.��1��Ŀǰ��Ӧ��NH3�Ĵ���ԭ���������������������ѳ�����ѧ��Ӧ�ɱ�ʾΪ��2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) ��H��0���÷�Ӧ�У���Ӧ��������_____(����>������<������=��)��������������
��2����֪4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ��H=-1800 kJ��mol-1����2 mol NH3��3 mol NO�Ļ������ֱ�����a��b��c����10 L�����ܱ������У�ʹ��Ӧ�ڲ�ͬ�����½��У���Ӧ������c(N2)��ʱ��ı仯��ͼ��ʾ��
5N2(g)+6H2O(g) ��H=-1800 kJ��mol-1����2 mol NH3��3 mol NO�Ļ������ֱ�����a��b��c����10 L�����ܱ������У�ʹ��Ӧ�ڲ�ͬ�����½��У���Ӧ������c(N2)��ʱ��ı仯��ͼ��ʾ��
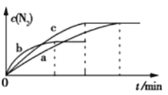
��������a�еķ�Ӧ��ȣ�����b�еķ�Ӧ�ı��ʵ������������_______���жϵ�������___________________��
��һ���¶��£�������˵����Ӧ�Ѵﵽƽ��״̬����____
A��H2O(g)��NO������������� B�����������ܶȱ��ֲ���
C����H���ֲ��� D����������ѹǿ���ֲ���
��3����NH3��Cl2��Ӧ�����Ʊ�����ǿ�����Ե����Ȱ������Ȱ������ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ����ʣ�������ʽΪ3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(������)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(������)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��T��__________400�棨����>������<������
�ڸ÷�Ӧ����H__________0������>������<������
�۸÷�Ӧ�Է����е�������__________������¡����¡��κ��¶ȣ���
�ܶԸ÷�Ӧ������˵����ȷ����_________����ѡ����ĸ����
A.�������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B.��������Cl2��NH3���ʵ���֮��Ϊ3��1���������Ӧ�ﵽƽ��״̬
C.��Ӧ�ﵽƽ��������������䣬��ԭ�����а�![]() ��������һ������Ӧ�����ƽ���Cl2��ת��������
��������һ������Ӧ�����ƽ���Cl2��ת��������
D.��Ӧ�ﵽƽ��������������䣬����һ������NC13��ƽ�⽫���淴Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Ũ�ȶ���1mol��L-1����������X2��Y2�����ܱ������з�Ӧ��������Z����Ӧ2 min��òμӷ�Ӧ��X2Ϊ0.6 mol��L-1����Y2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����v(Y2)��0.1 mol��(L��min)-1�����ɵ�c(Z)Ϊ0.4 mol��L-1����÷�Ӧ�ķ�Ӧʽ���Ա�ʾΪ�� ��
A. X2��2Y2![]() 2XY2 B. 2X2��Y2
2XY2 B. 2X2��Y2![]() 2X2Y
2X2Y
C. 3X2��Y2![]() 2X3Y D. X2��3Y2
2X3Y D. X2��3Y2![]() 2XY3
2XY3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com