
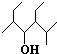
 的名称
的名称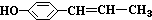 与足量浓Br2水充分反应:
与足量浓Br2水充分反应:
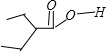 ,故答案为:
,故答案为: ;
;| 催化剂 |
| 催化剂 |
| 水浴 |
| △ |
| 水浴 |
| △ |
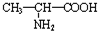 ,缩聚反应为:nCH3CH(NH2)COOH
,缩聚反应为:nCH3CH(NH2)COOH| 催化剂 |
 +(n-1)H2O,
+(n-1)H2O,| 催化剂 |
 +(n-1)H2O;
+(n-1)H2O;| 水 |
| △ |
| 水 |
| △ |
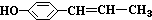 的对位有取代基,故反应的化学方程式为
的对位有取代基,故反应的化学方程式为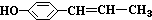 +2Br2→
+2Br2→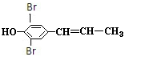 +2HBr,
+2HBr,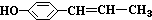 +2Br2→
+2Br2→ +2HBr;
+2HBr;

科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、5.4 kJ |
| B、350 kJ |
| C、3.5 kJ |
| D、8.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、大理石加入盐酸溶液中:CO32-+2H=═CO2↑+H2O |
| C、铁粉加入FeCl3溶液中:Fe+2Fe3+═3Fe2+ |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
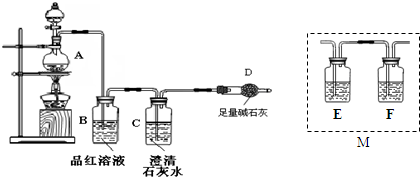
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com