
下列反应中,反应后固体物质增重的是( )
|
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 |
|
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
| 真题集萃;钠的重要化合物;镁、铝的重要化合物;铜金属及其重要化合物的主要性质. | |
| 专题: | 几种重要的金属及其化合物. |
| 分析: | A.发生氢气与CuO的反应生成Cu和水; B.发生二氧化碳与过氧化钠的反应生成碳酸钠和氧气; C.发生Al与Fe2O3反应生成Al2O3和Fe; D.发生Zn与Cu(NO3)2反应生成Zn(NO3)2和Cu. |
| 解答: | 解:A.发生氢气与CuO的反应生成Cu和水,反应前固体为CuO,反应后固体为Cu,固体质量减小,故A错误; B.发生二氧化碳与过氧化钠的反应生成碳酸钠和氧气,反应前固体为过氧化钠,反应后固体为碳酸钠,二者物质的量相同,固体质量增加,故B正确; C.发生Al与Fe2O3反应生成Al2O3和Fe,反应前固体为氧化铁、Al,反应后固体为氧化铝、Fe,均为固体,固体质量不变,故C错误; D.发生Zn与Cu(NO3)2反应生成Zn(NO3)2和Cu,反应前固体为Zn,反应后固体为Cu,二者物质的量相同,则固体质量减小,故D错误; 故选B. |
| 点评: | 本题为2014年高考试题,把握发生的化学反应及反应前后固体的分析为解答的关键,侧重元素化合物性质的考查,注意反应中物质的质量变化,题目难度不大. |


科目:高中化学 来源: 题型:
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为
A.0.224L B.0.672L C.0.112L D.0.336L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列设备工作时,将化学能转化为热能的是( )
| A | B | C | D |
|
|
|
|
|
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学是研究电和化学反应相互关系的科学.电池、电解都存在我们熟知的电化学反应.
(1)如图1是一种常见的一次锌锰酸性干电池.干电池工作时,负极上的电极反应式是: ,
MnO2的作用是除去正极上的气体产物,本身生成Mn2O3,该反应的化学方程式是: .
(2)以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.
已知铜的化合物的颜色、性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液绿色,稀溶液蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
取电解CuCl2溶液后的阴极碳棒附着物,洗涤、干燥,连接如图2装置进行实验,验证阴极产物.
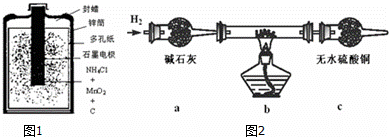
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质有无Cu2O? (填“有”或“无”),请简要说明的理由: .
②在c装置后将气体通入硝酸银溶液中,出现白色沉淀,说明根据表中性质推测的阴极碳棒上的少量白色物质一定存在.试写出上述装置b中发生反应的化学方程式: .
③由以上实验分析可知:电解CuCl2溶液的阴极上发生的电极反应式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钡的某种同位素是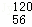 Ba,由学过的知识无法推断出的信息是( )
Ba,由学过的知识无法推断出的信息是( )
|
| A. | 钡原子的核外电子排布 | B. | 钡元素在周期表中的位置 |
|
| C. | 钡原子的核电荷数 | D. | 钡元素的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时某溶液中含有大量Na+、H+、Fe3+、HC03﹣、OH﹣、I﹣中的几种,并且水 电离出的c(H+)=1×lO﹣13 mol/L.当向该溶液中缓慢通入一定量的Cl2后,溶液由无色 变为黄色.下列有关分析正确的是( )
|
| A. | 溶液的pH=1或13 | B. | 溶液中一定没有Fe3+,Na+ |
|
| C. | 溶液中阴离子有I﹣,不能确定HCO3﹣ | D. | 当Cl2过量,所得溶液只含有两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
双球连通管中发生2NO2⇌N2O4+Q(Q>0).若同时向两烧杯中分别加入等温、等体积的蒸馏水(左)和0.1mol/L H2O2溶液(右),再向右侧烧杯中加入少量Fe2(SO4)3固体后,则下列有关推断中正确的是( )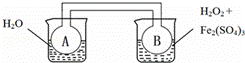
|
| A. | 实验时,A、B中的压强始终相等 |
|
| B. | 若右侧烧杯发生吸热反应,则A中更快达到平衡 |
|
| C. | 若右侧烧杯发生放热反应,则A中颜色较深 |
|
| D. | 能用该装置推断右侧烧杯中反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是( )
①pH=0的盐酸 ②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液 ④pH=11的NaOH溶液
A.1∶10∶100∶1 000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com