
氨气是重要的化工原料.实验室可用浓氨水和 来制取氨气.
a.烧碱 b.生石灰 c.氯化铵
(2)某实验小组设计了下列装置进行氨的催化氧化实验.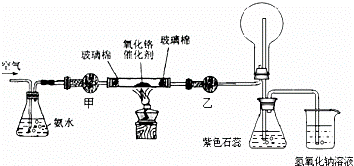
①盛放氨水的实验仪器的名称为 ;在加热条件下,硬质玻璃管中发生反应的化学方程式为 .
②实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是 .
③烧杯中盛有NaOH溶液的作用是 .
考点: 氨的实验室制法.
分析: (1)氨水易挥发,烧碱、生石灰溶于水放热,据此解答;
(2)①熟悉仪器形状,说出其名称;氨气催化氧化生成一氧化氮和水;
②一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵;
③尾气中含有氮的氧化物、氨气等气体,直接排放能够引起空气污染.
解答: 解:(1)烧碱溶于水放出大量的热,生石灰与水反应氢氧化钙放热,可促使氨气挥发,可用于制备氨气,
故答案为:ab;
(2)①盛放氨水的实验仪器的名称为锥形瓶,氨气催化氧化生成一氧化氮和水,方程式:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
②一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵,所以如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,烧瓶中先产生白雾,随即产生白烟;
故答案为:一氧化氮、氧气和水反应生成硝酸,硝酸吸收氨气生成硝酸铵;
③尾气中含有氮的氧化物、氨气等气体,直接排放能够引起空气污染,通入氢氧化钠溶液,可以吸收尾气,防止空气污染;
故答案为:吸收尾气,防止空气污染.
点评: 本题考查氨气的制备和性质的检验,熟悉制备原理和氨气的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
R2O8n﹣离子在一定条件下可以把Mn2﹣氧化为MnO4,若反应后R2O8n﹣离子变为RO42离子,知反应中氧化剂与还原剂的离子数之比为5:2,则R2O8n﹣离子中R元素的化合价以及n值分别为( )
|
| A. | +7、2 | B. | +6、2 | C. | +5、1 | D. | +4、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气里含有有毒的NO和CO,NO和CO能缓慢地反应生成N2和CO2.对此反应的下列叙述不正确的是( )
A. 使用催化剂能加快反应速率
B. 升高温度能加快反应速率
C. 改变压强对反应速率无影响
D. 此反应能减轻尾气对环境的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
黑火药爆炸时可发生如下反应:5S+16KNO3+16C=3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
A. S既作氧化剂又作还原剂
B. 消耗12gC时,反应转移5mol电子
C. 还原产物只有K2S
D. KNO3只发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计可如图所示的探究原电池的装置.下列有关说法正确的是( )
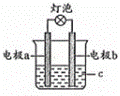
A. 电极材料必须是金属材料
B. 若a极为铜条、b极为锌片,c为蔗糖溶液时,灯泡会发亮
C. 若a极为铝条、b极为铜片,c为浓硝酸溶液时,铜为负极
D. 若a极为铝条、b极为镁片,c为稀硫酸溶液时,铝为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.分散质粒子的大小
C.是否能通过滤纸
D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于含有一定数目分子的气体,决定其体积的主要因素是( )
A.气体分子间的平均距离 B.气体的分子的形状
C.气体分子本身的大小 D.气体分子的种类
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语的描述正确的是( )
|
| A. | 氨水显碱性:NH3•H2O═NH4++OH﹣ |
|
| B. | Na2S溶液显碱性:S2﹣+2H2O⇌H2S+2OH﹣ |
|
| C. | 硫酸氢钠溶液显酸性:NaHSO4═Na++H++SO42﹣ |
|
| D. | AlCl3溶液显酸性:Al3++3H2O⇌Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用Na2SO3还原MnO4﹣,如果还原含有2.4×10﹣3 mol MnO4﹣的溶液时,消耗30mL0.2mol•L﹣1的Na2SO3溶液,则Mn元素在还原产物中化合价为( )
|
| A. | +1 | B. | +2 | C. | +4 | D. | +5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com