
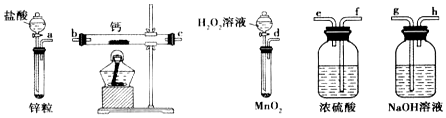

分析 (1)一般制备纯净干燥的气体的实验装置的顺序为:制备装置→除杂装置→干燥装置等;
(2)实验结束时为防止空气进入装置,还要继续通氧气直到装置冷却;
(3)①根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,据此书写化学方程式;
②由于过氧化氢和Ca2+反应会产生氢离子,用氨气中和氢离子,可以促使反应正向进行;
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2.8H2O,通过检验洗涤滤液中是否有氯离子判断CaO2.8H2O是否洗涤干净;
④结合题意可知,氧气的质量为mg-ng,根据反应2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑可求得过氧化钙的质量,进而确定质量分数.
解答 解:(1)制备过氧化钙时,用双氧水制备氧气,钙属于极活泼的金属,极易与水反应生成氢氧化钙和氢气,而制备的氧气中会混有水蒸气,所以在与钙化合之前需要干燥,选用试剂是浓硫酸;同时为防止空气中水蒸气进入,最后还需要连接浓硫酸的洗气瓶,所以正确的顺序为:dfebcf或dfecbf;
故答案为:dfebcf或dfecbf;
(2)实验结束时为防止空气进入装置,还要继续通氧气直到装置冷却,所以实验结束时的操作为熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞,
故答案为:熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
(3)①根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,反应的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O;
②由于过氧化氢和Ca2+反应会产生氢离子,用氨气中和氢离子,可以促使反应正向进行,所以氨气的作用为中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行(或使溶液呈碱性,减少CaO2•8H2O的溶解,或提高产品的产率),
故答案为:中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行(或使溶液呈碱性,减少CaO2•8H2O的溶解,或提高产品的产率);
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2.8H2O,通过检验洗涤滤液中是否有氯离子判断CaO2.8H2O是否洗涤干净,操作为取最后的洗涤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液,若没有白色沉淀生成,则说明已经洗涤干净;反之则说明未洗涤干净,
故答案为:取最后的洗涤液少许于试管中,先加入稀硝酸酸化,再滴加硝酸银溶液,若没有白色沉淀生成,则说明已经洗涤干净,反之则说明未洗涤干净;
④结合题意可知,氧气的质量为mg-ng,根据反应2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑可求得过氧化钙的质量为(m-n)g×$\frac{72×2}{32}$=4.5(m-n)g,所以产品中CaO2的质量分数为:$\frac{4.5(m-n)g}{mg}$×100%=$\frac{9(m-n)}{2m}$×100%,
故答案为:$\frac{9(m-n)}{2m}$×100%.
点评 本题考查实验方案的设计、物质组成及含量测定计算,题目难度中等,明确实验目的和实验原理为解答关键,注意掌握性质实验方案设计的与评价原则,明确探究物质组成及含量测定的方法,试题充分考查学生的分析理解能力及知识迁移应用能力.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
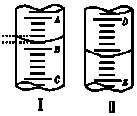 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为36 | |
| B. | 容器②中反应达到平衡时放出的热量为0.05QkJ 达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol•L-1 | |
| C. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于$\frac{2}{3}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com