
| A. | 金属钠与TiCl4溶液反应,可以置换出金属钛 | |
| B. | 氢氧化铝具有弱碱性,可用于做胃酸中和剂 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
分析 A、将钠投入到TiCl4溶液中,钠会先与水反应;
B、氢氧化铝是两性氢氧化物;
C、漂白粉具有漂白性的原因是由于其具有强氧化性;
D、氧化铁固体为红棕色.
解答 解:A、将钠投入到TiCl4溶液中,钠会先与水反应,生成的氢氧化钠再与TiCl4反应,不能置换出金属钛,故A错误;
B、氢氧化铝是两性氢氧化物,有弱碱性,能和胃酸HCl反应,从而能治疗胃酸过多,故B正确;
C、漂白粉具有漂白性的原因是由于其具有强氧化性,与漂白粉在空气中的稳定性无关,故C错误;
D、氧化铁固体为红棕色,故可以做红色涂料,与其能和酸反应无关,故D错误.
故选B.
点评 本题考查了物质间的关系,明确物质的性质是解本题关键,根据其性质分析用途,掌握物质的性质,灵活运用知识解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中.固体每增重mg,转移电子为0.2NA | |
| B. | 在准状况下,2.24LCl2与过量NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数为6NA | |
| D. | 标准状况下,22.4LCCl4中含有的碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
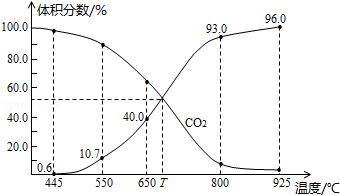
| A. | 550℃时,若充入惰性气体,v正,v逆均减小 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
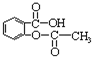 b.烯烃
b.烯烃 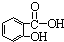 c.炔烃
c.炔烃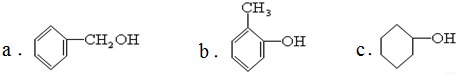
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸试剂的物质的量浓度为18.4 mol/L | |
| B. | 稀释该硫酸时应把水倒入硫酸中,边倒边搅拌 | |
| C. | 50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol | |
| D. | 标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如试管外壁有水,应在加热前擦拭干净 | |
| B. | 先使试管均匀受热,即先进行预热,然后把灯焰固定在放固体的部位加热 | |
| C. | 试管夹夹在距试管口约$\frac{1}{3}$处 | |
| D. | 加热完毕,立即用冷水冲洗试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
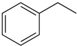 (g)→
(g)→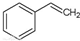 (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol; +CO(g)+H2O(g) △H=+158.8 kJ/mol
+CO(g)+H2O(g) △H=+158.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L丙烷中含有的共用电子对数为NA | |
| B. | 25℃时,pH=1的盐酸和醋酸溶液所含H+数均为0.1 NA | |
| C. | 利用双氧水制氧气,每生成1molO2转移电子数为4 NA | |
| D. | 100mL 12mo1•L-1的浓盐酸与足量MnO2加热反应,生成C12分子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com