
| A. | 用废弃动植物油脂与低碳醇通过酯交换反应制成生物柴油来代替柴油作为机车燃料,这种做法符合“绿色化学”理念 | |
| B. | 生物炼铜是利用生物质能转化为化学能的原理实现的 | |
| C. | 元素分析仪不但可以检测物质中的许多非金属元素,也可以检测金属元素 | |
| D. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 |
分析 A.绿色化学要求原料物质中所有的原子完全被利用且全部转入期望的产品中,原子的利用率100%,废动植物油脂经反应改性制成“生物柴油”,可实现变废为宝;
B.炼铜转化为化学能;
C.元素分析仪不仅可以非金属元素,还可以检验金属元素;
D.霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体.
解答 解:A.将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料,实现变废为宝,符合“绿色化学”的理念,故A正确;
B.生物炼铜为生物质能转化为化学能,故B错误;
C.元素分析仪不仅可以检验C、H、O、N、S等非金属元素,还可以检验Cr、Mn等金属元素,故C正确;
D.霾是由悬浮在大气中的大量微小尘粒、烟粒等直径小于2.5μm的颗粒物形成的,这些污染物称为PM2.5,故D正确.
故选B.
点评 本题考查环境污染及治理,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | v正(X)=2v正(Y) | |
| B. | 单位时间内生成1 mol Y的同时生成2molX | |
| C. | 混合气体的密度不再变化 | |
| D. | 反应容器中Y的质量分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
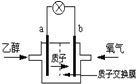 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | 电池工作时,1mol乙醇被氧化时就有6mol电子转移 | |
| B. | a极为电池的负极 | |
| C. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| D. | 电池正极的电极反应为:4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 200mL | C. | 150mL | D. | 50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
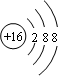 ;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.
;32g甲在足量浓硝酸中反应转移的电子数为2NA;甲在足量氧气中充分灼烧的化学方程式为Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
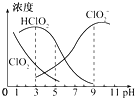 亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )
亚氯酸钠在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用 但ClO2是有毒的气体,25℃时各离子浓度随pH变化如图所示下列分析错误的是( )| A. | 25℃时HClO2的电离平衡常数Ka=10-6 | |
| B. | 使用漂白剂的最佳pH为3 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合混合溶液中c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 25℃时 用0.1000mol/LNaOH溶液滴定20.00ml某未知浓度的HClO2溶液 当滴入NaOH溶液体积为20.00ml时溶液呈中性 则HClO2溶液的实际浓度为0.11mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
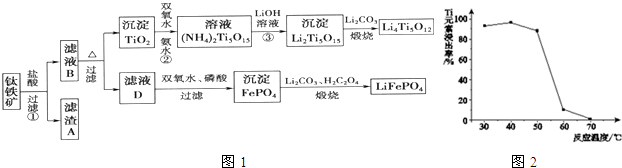
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com