
下列说法正确的是
A. H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B. 反应物的总能量低于生成物的总能量时,该反应为放热反应
C. 由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D. 已知:298K时,N2(g)+3H2(g)  2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:选择题
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+ O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
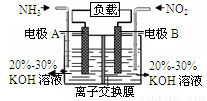
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:填空题
下列各组中的两种有机物,可能是(A)相同的物质(B)同系物(C)同分异构体等,请判断它们之间的关系(用A、B、C填空)
(1)2-甲基丁烷和丁烷 ________________
(2)正戊烷和2,2-二甲基丙烷___________________
(3)间二甲苯和乙苯_____________________
(4)1-已烯和环已烷____________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:选择题
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z | W |
初始浓度/mol•L﹣1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/mol•L﹣1 | 0.1 | 0.1 | 0.4 | 0.6 |
A. 反应达到平衡时,X的转化率为80%
B. 该反应的平衡常数表达式为k=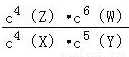
C. 增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:选择题
废电池造成污染的问题日益受到关注。下列有关电池的说法正确的是
A. 构成原电池的正极和负极必须是两种不同的金属
B. 弱电解质在水中的电离程度报小,不能用作电池的电解质溶液
C. 原电池是将化学能完全转变为电能的装置
D. 回收废旧电池,可防止汞、镉和铅等重金属对土壤和水源的污染
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:选择题
在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g) N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率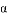 (N2O4)>(NO2)
(N2O4)>(NO2)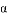
B. 平衡后,升高相同温度,以N2O4表示的反应速率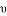 (Ⅰ)<
(Ⅰ)<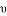 (Ⅱ)
(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)=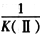
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:简答题
二氧化氯(ClO2)在水处理等方面有广泛应用,制备ClO2有下列两种方法:Na2SO4
方法一:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+______+2H2O
方法二:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(1)方法一中空白处的物质的化学式是________(该化学方程式已配平),反应的还原剂是______。若反应中电子转移数为0.1NA,则产生的气体标准状况下的体积为______L。
(2)方法二中盐酸表现的性质是________,该反应的还原产物是_______。
(3)根据方法二,实验室用NaClO3和8mol/L的盐酸反应即可反应制得ClO2。若使用12mol/L盐酸配制8mol/L的盐酸,实验室中需用到的计量仪器有________。所用的浓盐酸长时间放置在密闭性不好的容器中,最终所配制的盐酸的浓度有无变化?__________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:选择题
在某温度时,将nmol·L-1氨水滴入10 mL 1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
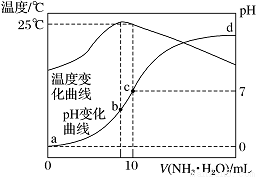
A. n=1.0
B. 水的电离程度:b>c>a>d
C. c点:c(NH)=c(Cl-)=1.0 mol·L-1
D. 25 ℃时,NH4Cl的水解常数(Kh)计算式为=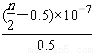
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com