
| 0.25mol |
| 5mol/L |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O?H++Cl-+HClO |
| B、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
| C、少量的CO2通入氨水中:CO2+NH3?H2O=NH4++HCO3- |
| D、用醋酸溶液除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
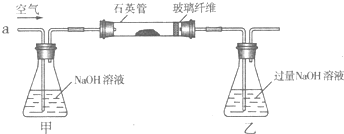 【化学--选修2化学与技术】
【化学--选修2化学与技术】
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
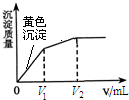 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、间二甲苯和乙苯 |
| B、2-甲基2,4-己二烯和3,4-二甲基-1-戊炔 |
| C、2,2,3-三甲基戊烷和3-乙基己烷 |
| D、2-甲基丙烯酸和甲酸正丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将图所示实验装置的K闭合,下列判断正确的是( )
将图所示实验装置的K闭合,下列判断正确的是( )| A、Cu是正极 |
| B、电子沿 Zn→a→b→Cu 路径流动 |
| C、盐桥中Cl-移向CuSO4溶液 |
| D、片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )上的加成反应,写出该反应产物的结构简式
)上的加成反应,写出该反应产物的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com