
当n=n0(n0>5)时,l的可能值是多少?轨道的总数是多少?各轨道的量子数取值是什么?
解析:电子运动状态的种数(各电子层最多可能容纳的电子数)
主量子数n | 1 | 2 | 3 | 4 | n | ||||||
电子层符号 | K | L | M | N | — | ||||||
角量子数l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | — |
电子亚层符号 | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | — | |
磁量子数m | 0 | 0 | 0、±1 | 0 | 0、±1 | 0、±1、±2 | 0 | 0、±1 | 0、±1、±2 | 0、±1、±2、±3 | — |
亚层轨道数 | 1 | 1 | 3 | 1 | 3 | 5 | 1 | 3 | 5 | 7 | — |
电子层轨道数 | 1 | 4 | 9 | 16 | n2 | ||||||
电子运动状态种数 | 2 | 8 | 18 | 32 | 2n2 | ||||||
答案:
主量子数n | 角量子数l | 磁量子数m | 原子轨道数 |
5 | 0 | 0 | 1 |
1 | 0,±1 | 3 | |
2 | 0,±1,±2 | 5 | |
3 | 0,±1,±2,±3 | 7 | |
4 | 0,±1,±2,±3,±4 | 9 | |
原子轨道总数 | 25 | ||
主量子数n | 角量子数l | 磁量子数m | 原子轨道数 |
n0(n0>5) | 0 | 0 | 1 |
1 | 0,±1 | 3 | |
2 | 0,±1,±2 | 5 | |
3 | 0,±1,±2,±3 | 7 | |
4 | 0,±1,±2,±3,±4 | 9 | |
…… | 0,±1,±2,±3,±4…… | …… | |
n0-1 | 0,±1,±2,±3,……,±(n0-1) | 2n0-1 | |
原子轨道数总计 | n02 | ||


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ▲ ,不能确定是否含有的离子(M)是 ▲ ,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是 ▲ 。
(2)沉淀I的化学式为 ▲ ,气体F的电子式为 ▲ 。
(3)写出生成A的离子方程式: ▲ 。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。请写出制备过程中的离子方程式 ▲ 。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为 ▲ 。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2011届浙江省金华一中高三高考模拟考试(理综)化学部分 题型:填空题
(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: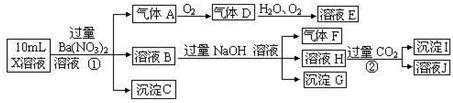
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ▲ ,不能确定是否含有的离子(M)是 ▲ ,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是 ▲ 。
▲ 。
(2)沉淀I的化学式为 ▲ ,气体F的电子式为 ▲ 。
(3)写出生成A的离子方程式: ▲ 。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。请写出制备过程中的离子方程式 ▲ 。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为 ▲ 。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省高三高考模拟考试(理综)化学部分 题型:填空题
(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ▲ ,不能确定是否含有的离子(M)是 ▲ ,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是 ▲ 。
(2)沉淀I的化学式为 ▲ ,气体F的电子式为 ▲ 。
(3)写出生成A的离子方程式: ▲ 。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。请写出制备过程中的离子方程式 ▲ 。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为 ▲ 。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com