
 燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.
燃煤烟气中含有大量的氮氧化合物(NOx),不宜直接排放到空气中,可采用以下措施对燃煤烟气进行处理.| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
分析 I.已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ/mol,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=bkJ/mol,
根据盖斯定律可知,(①+②)×$\frac{1}{2}$可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),反应热也进行相应的计算;
(1)时间、体积相同,速率之比等于甲烷的物质的量变化量之比;
(2)温度越高反应速率越快,根据前10min内甲烷物质的量变化量判断温度高低;由表中数据可知,温度T2到达平衡时,甲烷的物质的量大于温度T1时,结合温度对平衡的影响判断;
(3)根据甲烷物质的量,结合方程式计算参加反应二氧化氮物质的量,进而计算二氧化氮的转化率;欲提高NO2的转化率,应改变条件使平衡向正反应方向移动,但不能只增大二氧化氮的物质的量,结合外界条件对反应速率的影响判断;
II.反应中NO2为氧化剂,得到还原产物,NH3为还原剂,得到氧化产物,N2既是还原产物又是氧化产物,由N原子守恒可知氧化产物、还原产物的物质的量中为8:6=4:3,计算氧化产物或还原产物物质的量,结合N元素化合价变化计算转移电子物质的量.
解答 解:(1)I.已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=akJ/mol,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=bkJ/mol,
根据盖斯定律可知,(①+②)×$\frac{1}{2}$可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),其反应热△H=$\frac{△{H}_{1}+△{H}_{2}}{2}$=0.5(a+b)kJ/mol,热反应方程式为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=0.5(a+b)kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=0.5(a+b)kJ/mol;
(1)时间、体积相同,速率之比等于甲烷的物质的量变化量之比,故在0~10min内化学反应速率υNO2(T1):υNO2(T2)=(0.5-0.35):(0.5-0.3)=3:4,
故答案为:3:4;
(2)温度越高反应速率越快,根据前10min内甲烷物质的量变化量可知:T1<T2,由表中数据可知,温度T2到达平衡时,甲烷的物质的量大于温度T1时,说明升高温度平衡向逆反应方向移动,故a<0,
故答案为:<;<;
(3)前10min甲烷物质的量变化量为0.5mol-0.35mol=0.15mol,根据方程式可知参加反应二氧化氮物质的量为0.15mol×4=0.6mol,故二氧化氮的转化率为$\frac{0.6mol}{1.2mol}$×100%=50%;
A.缩小容器体积,压强增大,反应速率加快,但平衡向逆反应方向移动,NO2的转化率降低,故A错误;
B.增大CH4浓度,反应速率加快,但平衡向酯化反应方向移动,NO2的转化率增大,故B正确;
C.降低温度,反应速率减慢,故C错误;
D.加入催化剂,加快反应速率,但不影响平衡移动,NO2的转化率不变,故D错误,
故答案为:50%;B;
II.反应中NO2为氧化剂,得到还原产物,NH3为还原剂,得到氧化产物,N2既是还原产物又是氧化产物,由N原子守恒可知氧化产物、还原产物的物质的量中为8:6=4:3,设氧化产物、还原产物的物质的量分别为4ymol、3ymol,则(4y-3y)mol×28g/mol=14,解得y=0.5,故转移电子为4×0.5mol×2×[0-(-3)]=12mol,
故答案为:12mol.
点评 本题考查盖斯定律应用、反应速率计算、化学平衡计算及影响因素、氧化还原反应计算等,侧重考查学生的分析计算能力,难度中等.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题
 (1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组设计实验元素周期表中元素的性质,请回答下列问题
某化学小组设计实验元素周期表中元素的性质,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. |  当液体变成红褐色时,停止加热,让光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH(g)+O2(g)═H2O(1)+CO2(g)+2H+(aq)+2e - | |
| B. | O2(g)+4H+(aq)+4e -═2H2C(1) | |
| C. | CH3OH(g)+H2O(1)═CO2(g)+6H+(aq)+6e - | |
| D. | O2(g)+2H2O(1)+4e -═4OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
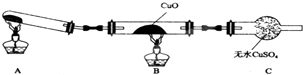 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | 氯化钠固体不导电,所以氯化钠不是电解质 | |
| C. | 氯化氢溶液能导电,所以氯化氢是电解质 | |
| D. | 氯气溶于水能导电,所以氯气是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com