

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl����/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| ƽ��ʵ����� | 1 | 2 | 3 |
| 0.25g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
���� Ҫ��������ӡˢ��·�ķ�Һ�Ʊ��Ȼ���ͭ������Ӧ�Ʊ��������ͭ����ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-��������������ۣ����������������۷�Ӧת��Ϊ���������ӣ�ͭ����������Ӧ����ͭ��Ȼ����ˣ�����Ϊ�������������ɵ�ͭ������ͭ���������ԣ��������������ᣬͭ�������Ӧ�����˵õ�������Ϊͭ��Ȼ��ͭ��Ũ���ᷴӦ��������ͭ�Ͷ�������ͭ��������Ӧ�����Ȼ�ͭ������ͭ�����������Ȼ�ͭ��Ӧ�����Ȼ���ͭ��
��1��ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-���������������������ܹ�ԭ����Ӧ���ɶ��������ӣ�ͭ�����ܹ�������Ӧ����ͭ��
��2������ͼʾ��֪��CuCl2��CuSO4��SO2��H2O��Ӧ����H2SO4��CuCl�����ݵ�ʧ�����غ���ƽ����ʽ��
��3������ͼʾ��֪��ͭ��Ũ���ᷴӦ��������ͭ��������������ʵ���֮��Ϊ1��1��������CuCl�Ļ�ѧ����ʽ������ͭ�������������ʵ���֮��ǡ��Ϊ1��1��
��4������ͼ��CuCl���ʿ�֪PH=2�������pH�ϴ�ʱCuCl���ʱ�ͣ�Cu2+ˮ��̶��������ɵ��Ȼ���ͭ�٣�����ϡ�������ǿ�����Է�����
��5�����ݷ���ʽ�и���Ӧ����֮��Ĺ�ϵ����CuCl�Ĵ��ȣ�CuCl+FeCl3�TCuCl2+FeCl2��Fe2++Ce4+=Fe3++Ce3+��CuCl��Ce4+���������ݼ�ƽ��ʵ�������ܳ���1%�����Ϊ24.35mL��������ȥ���ݴ˽��н��
��� �⣺��ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-��������������ۣ����������������۷�Ӧת��Ϊ���������ӣ�ͭ����������Ӧ����ͭ��Ȼ����ˣ�����Ϊ�������������ɵ�ͭ������ͭ���������ԣ��������������ᣬͭ�������Ӧ�����˵õ�������Ϊͭ��Ȼ��ͭ��Ũ���ᷴӦ��������ͭ�Ͷ�������ͭ��������Ӧ�����Ȼ�ͭ������ͭ�����������Ȼ�ͭ��Ӧ�����Ȼ���ͭ��
��1��ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-���������������������ܹ�ԭ����Ӧ���ɶ��������ӣ�ͭ�����ܹ�������Ӧ����ͭ�����˺������к���ͭ�������������ᣬ�������ᷴӦ�����Ȼ�������ͭ�������Ӧ����ͭ�����������XΪFe��YΪHCl��
�ʴ�Ϊ��Fe��
��2������ͼʾ��֪��CuCl2��CuSO4��SO2��H2O��Ӧ����H2SO4��CuCl�����ݵ�ʧ�����غ��䷽��ʽΪ��CuCl2+CuSO4+SO2+2H2O=2CuCl��+2H2SO4��
�ʴ�Ϊ��CuCl2+CuSO4+SO2+2H2O=2CuCl��+2H2SO4��
��3���ɷ�Ӧ����ʽCu+2 H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��֪Cu��Ũ���ᷴӦ�Ĺ�������SO2���ɣ������ɵ�CuSO4��SO2�����ʵ���֮��Ϊ1��1������CuCl�Ĺ���������CuSO4��SO2�����ʵ���֮��ҲΪ1��1�����������ϲ���Ҫ����SO2���壻
ʵ��������Ҫ�����ʵ�������SO2��Ŀ�������Cu2+�Ļ�ԭ���ʣ�ͬʱ���Է�ֹ���ɵ�Cu+������������
�ʴ�Ϊ��Cu+2 H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��Ӧ�����ɵ�CuSO4��SO2Ϊ1��1�����������ϲ���Ҫ����SO2���壻���Cu2+�Ļ�ԭ���ʣ�ͬʱ���Է�ֹ���ɵ�Cu+������������
��4���ɱ������ݿ�֪��pH=2ʱ��CuCl������ߣ�pH�ϴ�ʱ��Cu2+ˮ��̶������·�Ӧ����CuCl���٣��������ǿ�����ԣ��ܽ���ƷCuCl��������Cu2+�����Բ�������ͬpH������������ᣬ
�ʴ�Ϊ��2��Cu2+ˮ��̶�����Ӧ����CuCl���٣����ʼ�С����������ƷCuCl������Ӧ��
��5��������Ŀ���������ݼ�ƽ��ʵ�������ܳ���1%�����Ϊ24.35mL��������ȥ����ζ�0.25g��Ʒ�������������Һ��ƽ�����Ϊ��$\frac{24.05+23.95}{2}$=24mL����Ϸ���ʽ��֪��CuCl+FeCl3�TCuCl2+FeCl2��Fe2++Ce4+=Fe3++Ce3+��
CuCl��Ce4+��
CuCl�Ĵ���Ϊ��$\frac{24��1{0}^{-3}L��0.1mol/L��99.5g/mol}{0.25g}$��100%=95.5%��
�ʴ�Ϊ��95.5%��
���� ���⿼�����Ʊ���������ƣ���Ŀ�Ѷ��еȣ�����ʵ��������ȷʵ��Ŀ�ġ�ʵ��ԭ��Ϊ���ؼ�������֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ�����ѧ���ķ�����������������ѧʵ��������


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
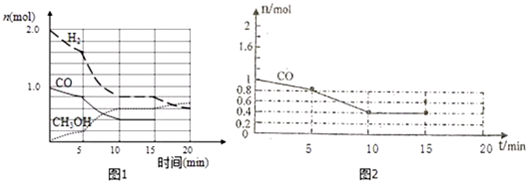
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
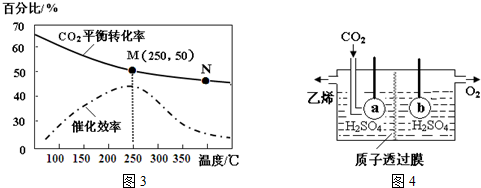
 ��N2F2������Nԭ�ӵ��ӻ���ʽ��sp2��1mol N2F2����1.806��1024���Ҽ���
��N2F2������Nԭ�ӵ��ӻ���ʽ��sp2��1mol N2F2����1.806��1024���Ҽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ���� | ���� |
| A | ��1mL 0.1mol/LAgNO3��Һ�еμ�2��0.1mol/LNaCl��Һ�����ٵμ�2��0.1mol/LKI��Һ | �Ȳ�����ɫ�������������ɫ���� | Ksp��AgCl����Ksp��AgI�� |
| B | ����ʢ��Ũ����Ϳɳ鶯ͭ˿���Թܣ���������������ͨ�뵽Ʒ����Һ�� | Ʒ����Һ��ɫ�����Թ���ֻ������ɫ��Һ | Ũ�������ǿ������ |
| C | ���ϩ����HOCH2CH=CH2���е����������Ը��������Һ | ��Һ�Ϻ�ɫ��ȥ | ��ϩ���к���̼̼˫�� |
| D | ̼������Һ�еμ�ϡ���������������ͨ�뵽��������Һ�� | ������ɫ���� | �ǽ����ԣ�S��C��Si |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X | Y | Z | |
| ԭ�Ӱ뾶/nm | 0.154 | 0.130 | 0.071 |
| A�� | ԭ��������������Z��X��Y | B�� | ����Ԫ�ؿ���Ϊͬ����Ԫ�� | ||
| C�� | ԭ��������Y��X��Z | D�� | ���Ӱ뾶��X��Y��Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ��ʯ��������������ˮ�ࡢ�Ʋ��� | |
| B�� | ʹ�ñ�����ƾ������ֻ���Ļ | |
| C�� | ͬλ��ʾ�ٷ�������������ǿ�ѧ�Ҿ���ʹ�õ��о���ѧ��Ӧ���̵��ֶ�֮һ | |
| D�� | ���H7N9�����е���ɢ�����Ҫ��ǿ���������˵ȵ�����Ԥ������ѡ�ú������������ƾ���˫��ˮ����Ϊ�����������ִ�������������ɫ��ѧ�ĺ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ģ�� ���Ա�ʾ������̼���� ���Ա�ʾ������̼���� | |
| B�� | S2-�Ľṹʾ��ͼ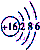 | |
| C�� | ����ʽ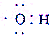 ���Ա�ʾ�ǻ���Ҳ���Ա�ʾ���������� ���Ա�ʾ�ǻ���Ҳ���Ա�ʾ���������� | |
| D�� | ��������COCl2���ṹʽ��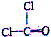 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHCO3��Һ��ϡH2SO4��Ӧ��CO32-+2H+�TH2O+CO2�� | |
| B�� | ��20mL1mol/L��FeBr2��Һ��ͨ��0.02molCl2��2Fe2++2Br-+2Cl2�T2Fe3++Br2+4Cl- | |
| C�� | ��Ư����Һ��ͨ��������SO2��SO2+Ca2++2ClO-+H2O�TCaSO3��+2HClO | |
| D�� | ��������CuSO4��Һ��Ӧ��2Na+Cu2+�TCu+2Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
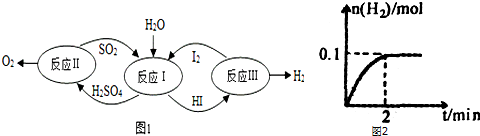
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com