
下列有关实验操作的叙述正确的是
| A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
| B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的上端倒出 |
| D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 |
A
解析试题分析:氯化铁是能够水解的强酸弱碱盐,即FeCl3+3H2O Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
考点:考查化学实验基本操作,涉及配制能水解的盐溶液的方法、焰色反应、钠元素的焰色反应、萃取、四氯化碳与水的密度关系、酸碱中和滴定、锥形瓶的使用方法等。


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:单选题
下述实验方案能达到实验目的的是
| 编号 | A | B | C | D |
| 实验 方案 |  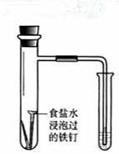 食盐水 |  片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 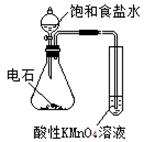 | 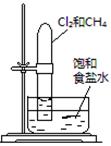 置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作及现象能够达到对应实验目的的是
| | 实验内容 | 实验目的 |
| A | 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaSO4)>KSP(BaCO3) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下三种测定方法。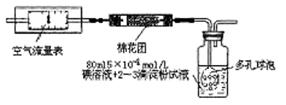
I.氧化还原法:甲同学根据化学反应原理SO2+I2+2H2O=H2SO4+2HI设计了如下图所示的装置进行实验:
(1)该实验需80ml浓度为5×10-4mol/L的碘
溶液,甲同学应选择 ml的容量瓶进行配制。
(2)广口瓶中使用多孔球泡的目的是 。
(3)在甲同学所配碘溶液浓度准确,并且量取药品及 实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因(至少写两种原因)
II.重量法:乙同学拟用实验室常用仪器组成简易装置测定空气中的SO2含量。实验操作过下:
按如下实验装置图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20ml的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀(H2SO4+BaCl2=BaSO4↓+2HCl),经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.18mg。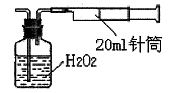
(4)取样处空气中SO2含量为 mg/L(精确到0.001)。
(5)现查阅资料知,常温下BaSO3的Ksp为5.48×10-7,饱和亚硫酸溶液中c(SO32-)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.lmol/L BaCl2溶液来吸收SO2即可产生沉淀,你认为这样做 (填“正确”或“不正确”),请利用以上数据简述理由 。
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4。
(6)请写出该电池负极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作不正确的是
A. B. C. D. A.定容
A.定容
B.比较硫、碳、硅三种元素的非金属性强弱
C.处理尾气
D.测定黄铜(Cu、Zn合金) 中Zn的含量
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 ( )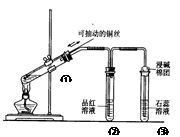
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中品红溶液不褪色 |
| C.③中石蕊溶液变蓝色 |
| D.为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氯异氰尿酸(结构简式如图)是一种极强的氧化剂和氯化剂。
(1)利用三氯异氰尿酸水解产物中的氧化性物质X可消毒灭菌,X的分子式为 。
(2)“有效氯”含量指从KI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。为测定三氯异氰尿酸的“有效氯”含量,现称取某三氯异氰尿酸样品0.5680 g,加水、足量KI、硫酸,配制成100 mL待测液;准确量取25.00 mL待测液于碘量瓶中,用0.1500 mol·L-1 Na2S2O3标准溶液滴定至溶液呈微黄色时,加入淀粉指示剂,继续滴定至终点(发生反应的方程式为:2Na2S2O3+I2=Na2S4O6+2NaI);重复测定2次,所得的相关数据如下表:
| 滴定序号 | 待测液体积/mL | 标准液滴定管起点读数/mL | 标准液滴定管终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO32—+2IO3—+2H+ I2+5SO42—+H2O
I2+5SO42—+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3—的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在; 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用下图所示装置进行实验,下表中实验结果能说明结论的是( )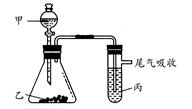
| | 甲 | 乙 | 丙 | 结论 |
| A | 水 | 电石 | 溴水 | 稳定性:水>C2H2>Br2 |
| B | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性:HCl>H2CO3>苯酚 |
| C | 盐酸 | FeS | 溴水 | 还原性:S2->Br->Cl- |
| D | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4<Cl2<Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com